| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16.02.11 14:05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 10 из 12
Такие соли, как (NH4)2CO3 и (NH4)2S в водном растворе практически полностью гидролизуются.
Если эти соли используются в качестве реагентов, то для подавления их гидролиза в раствор добавляют NH4OH. В ряде случаев при гидролизе солей образуются основные соли, которые выпадают в осадок, препятствуя полному протеканию процесса.
Контрольные задания (142-162) Вычислите Кгидр. и рН среды растворов солей заданной концентрации (С, моль/л). Таблица 3.4
Примечание: NаВnz – бензоат натрия; 4. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ Даже если вещество малорастворимо в воде, незначительное количество его все же переходит в раствор и диссоциирует на ионы, например,
Произведение концентраций этих ионов, в данном случае [ Введение в раствор одноименного иона (в виде другой соли) не изменяет ПР и, следовательно, уменьшает концентрацию противоиона. Например, при добавлении к насыщенному раствору АgСl хлористого натрия (0,1 моль./л), полностью диссоциирующего в воде, содержание ионов серебра в растворе резко уменьшится, что можно использовать в практических целях при осаждении серебра. В растворе АgСl без добавок:
При введении хлорида натрия концентрация ионов хлора составит [Аg+] 0,1 = 1,78 10-10; [Аg+] = Зная растворимость электролита, легко вичислить его ПР, и наоборот. Пример 1. Растворимость сульфата бария при 25оС равна 0,00245 г/л. Вычислить Решение .
При диссоциации 1 моля ВаSО4 образуется 1 моль иона Ва2+ и 1 моль иона
Пример 2 . Вычислить растворимость сульфата бария при 25oС, если Решение:
Растворимость ВаSO4 равна Контрольные задания (163-180) (табл.4.1.) Исходя из значения ПР при 25оС, определите растворимость указанной соли (г/л). Расчитайте концентрацию иона металла при введении в раствор одноименного иона с заданной концентрацией. Таблица 4.1
|
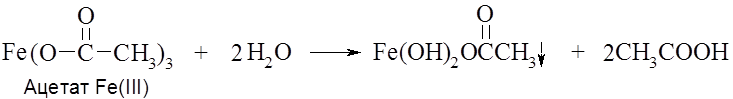
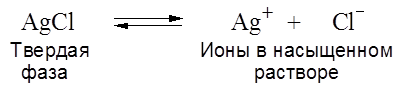
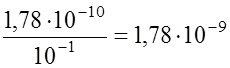 моль/л.
моль/л.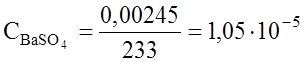 моль/л.
моль/л.


