| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator |
| 16.02.11 14:05 |
|
Страница 9 из 12
Соль, образованная сильным основанием и сильной кислотой в растворе диссоциирует, но гидролизу не подвергаются. Соль, образованная сильным основанием и слабой кислотой (NaAc, NaHCO3, NaHS и др.), гидролизуется по аниону (именно анион образует с Соли, образованные слабым основанием и слабой кислотой (Fe2S3, (NH4)2CO3, Fe 2(CO3)3, CuS и др.) гидролизуются практически нацело по катиону и аниону. Для примера рассмотрим гидролиз ацетата натрия (N = 0,1 моль/л).
Поскольку
Поскольку Для NaAc: Определяем рН раствора гидролизуемой соли. Из уравнения (1) видно, что
NaAc в растворе полностью диссоциирует. Поэтому
Рассуждая аналогично, можно показать, что в случае гидролиза соли, образованной слабым основанием и сильной кислотой:
В случае же соли, образованной слабым основанием и слабой кислотой:
|
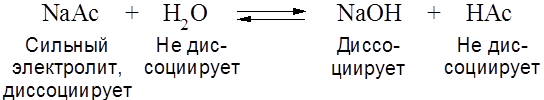
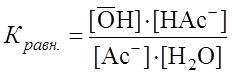 .
.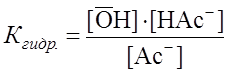 . (2)
. (2)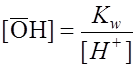 .
.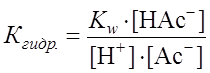 .
.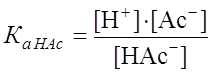 , то
, то  ;
; 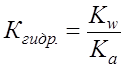 .
.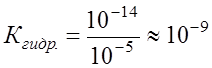 .
.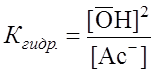 .
.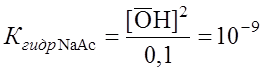 ;
;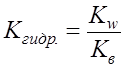 .
.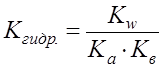 .
.


