| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16.02.11 14:05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 6 из 12
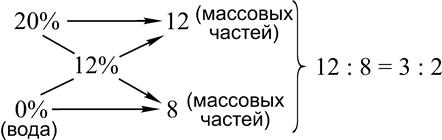
Пример 5. Приготовьте 12%-ный раствор хлорида натрия на основе 20%-ного раствора:
Для приготовления 12%-ного раствора необходимо смешивать 3 массовых части 20%-ного раствора и 2 части воды. Пример 6. Приготовить 12%-ный раствор соли на основе 20%-ного и 8%-ного растворов.
К одной массовой части 20%-ного раствора соли необходимо добавить 2 части 8%-ного раствора. 2.9. Определение концентрации растворов, Концентрацию кислоты, например НСl, можно определить титрованием (медленной обработкой по каплям) аликвоты (объемной части) этого растворастандартным раствором щелочи, то есть раствором с точно установленной концентрацией КОН. Такие растворы обычно готовятся на основе фиксанала – запаянного в ампулу в условиях завода химреактивов точно взвешенного количества щелочи. Титрование проводят в присутствии индикатора. Например, индикатор метиловый оранжевый в кислой среде (рН < 3,1) имеет красную окраску, а в слабокислой и щелочной (рН > 4,4) – желтую окраску. Изменение окраски раствора с красной на желтую в условиях титрования кислоты свидетельствует о достижении точки эквивалентности. То есть, в раствор внесено столько эквивалентов щелочи, сколько в нем эквивалентов кислоты, что находится в соответствии с законом эквивалентных отношений. Количество эквивалентов щелочи, израсходованной на титрование кислоты в аликвоте, равно VКОН · NКОН. Тогда, VHCL · NHCL = VКОН · NКОН . Допустим, на титрование НСl, содержащегося в 15,5 мл. соляной кислоты израсходовано 20,2 мл. 0,1 Н раствора NаОН. Концентрацию соляной кислоты определяем по уравнению: 15,5 ·NHCL = 20,2 · 0,1. NHCL = Контрольные задания (43-60) Вычислите параметры раствора в соответствии с требованиями “правила этикетки” (С, моль/л; N, моль/л; массовую долю w, %; Т, г/см3, плотность Таблица 2.3
Продолжение табл. 2.3
Примечание: Факторы эквивалентности Н2SO4 и Н3РО4 принимаем равными соответственно 1/2 и 1/3. Контрольные задания 61-81 (табл. 2.4) У Вас в лаборатории имеется три раствора с концентрациями соответственно С = 12 моль/л, N = 20 моль экв./л (упрощенно 20 моль/л) и w = 90%. Приготовьте методом разбавления растворы с концентрациями, указанными в вашем задании. Таблица 2.4
Примечание: 6М = 6 моль/л. Контрольные задания (82-102)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
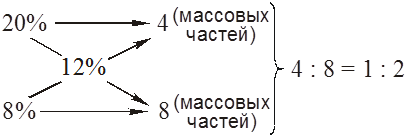
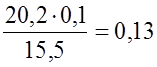 моль/л (или 0,13 моль экв./л).
моль/л (или 0,13 моль экв./л).


