| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16.02.11 14:05 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 7 из 12
Используя правило креста, приготовьте два раствора с заданными концентрациями соли.
Таблица 2.5
3. ОПРЕДЕЛЕНИЕ рН И рОН РАСТВОРОВ 3.1. Определение рН и рОН растворов сильных и При решении задач этого типа необходимо помнить, во-первых, что произведение концентраций ионов [ р Н + рОН = 14. Во-вторых, концентрация этих и других ионов в расчетах такого типа имеет нормальное выражение (N моль экв./л, или N моль/л). Пример 1. Определите рН 0,1 н раствора НСl. Решение . Сильные кислоты в разбавленных растворах диссоциируют полностью. Следовательно: [ Пример 2. Определите рН 0,1 н раствора уксусной кислоты Решение. Ка = Поскольку [ Тогда Пример 3. Определите рН 0,1н раствора NаОН. Решение. Поскольку щелочи в разбавленных растворах диссоциируют полностью, то [ p OH = –lg 10–1 = 1; pH = 14 – 1 = 13. Контрольные задания 102-121 (табл. 3.1) Определите рН растворов кислот и щелочей заданной концентрации. Таблица 3.1
Примечание : Для упрощения расчетов принимаем значения констант равными: КаНАс=10-5, 3.2. Определение рН буферных растворов Буферные растворы – это бифункционаньные системы, поддерживающие рН среды постоянным при введении в них кислот или оснований. Обычно эти растворы содержат смесь слабого основания и слабой кислоты, содержащие одноименные ионы (табл. 3.2). Буферными свойствами обладают почва, кровь, лимфа и другие биологические жидкости. Соль сильного основания и слабой кислоты, например, ацетат натрия, классифицируется как слабое основание, так как в водной среде она частично гидролизуется и создает щелочную среду. Выражаясь популярным языком, в молекуле этой соли основное начало выражено сильнее, чем кислотное. Таблица 3.2 Буферные растворы, применяемые в химическом анализе
Примечание : Варьируя концентрациями основания и кислоты можно получить буферные растворы с заданными величинами рН. Соль же слабого основания и сильной кислоты, например хлористый аммоний, представляет собой слабую кислоту.
|
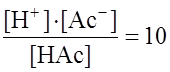 .
.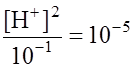 ;
;