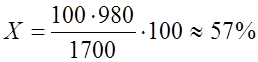| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16.02.11 14:05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 5 из 12
Клапейрон объединил эти законы и вывел уравнение:
которое позволяет газовую систему с различными параметрами (V, P, T) привести к нормальным условиям. Контрольные задания (26-34) (табл. 2.2) 26-34. Сформулируйте основные стехиометрические (количественные) законы химии: 1. Закон постоянства состава. 2. Закон эквивалентов (Дальтон). 3. Закон Авогадро. 4. Используя уравнение Клапейрона:
определите какой объем займет газ СО2 при нормальных условиях, если при 27оС и давлении 2,02·105 Па (2 атм.) его объем составляет 100 мл? Сделайте расчет и заполните для своего задания пропуски в таблице 2.2. Например, в первой части задачи №27 надо найти массу одного моля хлора, массу и объем 3,01·1022 молекул хлора и количество молей, соответствующее этому числу молекул. Контрольные задания (35-42) 35. Определите эквивалент металла, если 0,27 г его вытесняет при взаимодействии с НСl при 20оС и давлении 750 мм.рт.ст. 365 мл Н2. Таблица 2.2
36. Определите эквивалент металла, если после восстановления молекулярным водородом 0,4 г соответствующего оксида образовалось 0,32 г этого металла. 37. Определите молярную массу алкана, если 5,6 л его при н.у. весят 4 г. 38. Смешаны равные по массе количества газов: водорода, азота и метана. Вычислите массу 1 л этой смеси при нормальных условиях. 39. Вычислите молярную массу газообразного вещества, если известно, что оно при 27оС и 101,325 кПа занимает объем 480 мл и весит 0,6 г. 40. 2 г магния вытесняют 0,164 г водорода, 17,7 г серебра и 10,5 г меди из соединений этих элементов. Найти эквиваленты этих металлов. 41. На сжигание 1 г металла требуется 462 мл кислорода при нормальных условиях. Определите его эквивалент и формулу. 42. Определите формулу вещества, если при полном сжигании его навески 2,66 г получилось 1,54 г СО2 и 4,48 сернистого газа. 2.8. Приготовление растворов заданной концентрации. Перерасчет одной формы выражения концентрации Приведем несколько типичных примеров перерасчета форм выражения концентрации. Пример 1. В лабораторию поступил бутыль с концентрированной (w = 98%) серной кислотой. Перед вами поставлена задача: приклеить на бутыль этикетку, на которой будут указаны важные в практическом отношении параметры: процентная, молярная и нормальная концентрации, титр (Т) и плотность ( Проводим следующие расчеты. Процентная концентрация указывает на то, что в 100 г раствора содержится 98 г чистой кислоты. Необходимо массу раствора выразить в мл, а массу собственно кислоты – в молях. Плотность раствора находим в справочнике, или определяем с помощью ареометра, или вычисляем весовым методом (взвешиванием точно отмеренной аликвоты в мл.) Допустим 98 г Н2SО4 составляют 98/98 = 1 моль.
Один моль содержит 2 эквивалента серной кислоты. Следовательно, нормальная концентрация кислоты составляет: N = 16,6 Пример 2. В лабораторию поступила серная кислота с концентрацией 10 моль/л. Необходимо в соответствии с “правилом этикетки” обозначить на емкости с реактивом указанные в предыдущем примере характеристики. Рассуждаем следующим образом. Молярная концентрация 10 моль/л указывает на то, что в 1000 мл раствора – 10 молей серной кислоты. Выражаем массу раствора и массу собственно кислоты в граммах. Допустим, Итак, в 1700 г раствора содержится 980 г серной кислоты, тогда в
На основании параметров, указанных на этикетке, можно легко сделать расчет для приготовления раствора более низкой концентрации методом разбавления или по правилу креста. Пример 3. Приготовьте на основе 10 М раствора серной кислоты 0,5 молярный раствор. Аликвоту концентрированной Н2SО4, выраженную в мл, необходимо разбавить в 10 : 0,5 = 20 раз. Следовательно, к 1 мл исходного раствора надо добавить воды столько, чтобы получить объем 20 мл. 1 + Х = 20; Х = 19 мл Н2О; Пример 4. Приготовьте на основе 57%-ной серной кислоты 3%-ный раствор кислоты. В этом случае необходимо оперировать граммами раствора. Аликвоту концентрированной серной кислоты, выраженную в граммах, необходимо разбавить в 57 : 3 = 19 раз. Следовательно, к 1 г 57%-ной серной кислоты необходимо добавить 18 г воды. При этом получим 19 г 1%-ного раствора. Вспомним также в этой связи правило креста.
|
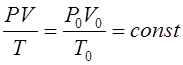 ,
,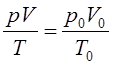 ,
,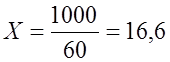 моль/л.
моль/л.