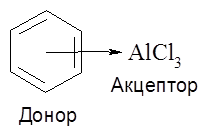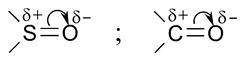| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator |
| 16.02.11 14:05 |
|
Страница 3 из 12
Образование химической связи является результатом перекрывания двух АО. При этом, чаще всего, партнеры по связи предоставляют в общее владение по одному электрону, образуя ковалентную связь. Итак, двухэлектронное, теперь уже молекулярное облако и есть тем звеном, которое связывает ядра двух атомов за счет электростатического взаимодействия. Элемент околоядерного пространства, занятый двумя обобществленными электронами, называется молекулярной орбиталью (МО). Общий вывод: в атоме электроны существуют на атомных орбиталях, а в молекуле – на молекулярных орбиталях. АО могут прекрываться либо при совпадении осей, либо при параллельном их расположении. В случае осевого перекрывания АО образуются
Образование атомом связей с другими атомами связано с выравниванием (усреднением) молекулярных орбиталей, называемым гибридизацией. Найдите ответ на вопросы: что такое гибридизация и в чем заключаются особенности гибридизации типов sр3, sр2, sр? Если один партнер по связи обладает намного большим сродством к электрону (например Сl), чем другой (например Na), то обобществленная пара электронов может практически полностью перейти во владение первого. При этом образуется ионная связь, обусловленная электростатическим взаимодействием ионов:
Вариантом ковалентной связи является донорно-акцепторная связь. В этом случае один партнер по связи (донор) предоставляет пару электронов в общее владение на вакантную орбиталь другого партнера (акцептора).
Существуют также водородная связь и трехцентровые (мостиковые) связи. 2.3. Электронные эффекты в молекулах. Если связь образуют элементы, отличающиеся по электроотрицательности (сродству к электрону), то она поляризуется. Поляризация нескольких связей суммарно может привести к поляризации всей молекулы. Различают два типа электронных смещений: индукционный эффект (
Смещение электронов на кислород и хлор приводит к появлению на них дробных (частичных) отрицательных зарядов ( Еще легче, чем
Индукционному и мезомерному эффектам приписывается знак минус (–I-эфф., –М-эфф.), если атом (группа атомов) оттягивает электроны на себя, и знак плюс ( Мезомерный эффект особенно эффективен при наличии в молекуле системы сопряжения. Сопряжение – это взаимодействие Электронные облака эффективно взаимодействуют при условии, если их разделяет Без понимания природы электронных смещений мы не сможем понять ни зависимость силы кислот и оснований от их электронного строения, ни факторов определяющих стабильность промежуточных частиц (катионов, анионов, радикалов), ни реакционной способности соединений в целом. Почему каротин имеет ярко-оранжевую окраску? Потому, что ее молекула содержит 11 двойных связей, чередующихся с Почему серная кислота сильнее сернистой, а по второй константе диссоциации она гораздо слабее, чем по первой? Ответ на этот вопрос и на многие другие вопросы, которые будут возникать в процессе изучения химии, следует искать в электронных эффектах и поляризации молекул. Контрольные задания (17-23) 17. Дайте определение атомной и молекулярной орбиталей. Покажите графически s-, р- и d- орбитали и варианты их перекрывания с образованием 18. Покажите механизм образования связей в молекулах: СН4, Н2С = СН2, НС Какой тип гибридизации проявляется в каждом случае? Почему молекула воды имеет угловое строение, а ацетилена – линейное? 19. Дайте определение электронных эффектов в молекулах: индукционного, мезомерного и эффекта сопряжения. Приведите конкретные примеры структур и проявляющиеся в них эффекты. 20. Что такое гибридизация молекулярных орбиталей ( 21. Дайте определение и приведите конкретные примеры ковалентной, ионной, донорно-акцепторной, семиполярной и водородной связей. Трехцентровые (мостиковые) связи. Покажите поляризацию 22. Что такое ковалентная связь? Приведите примеры неполярной, малополярной, сильно полярной ковалентных связей. Покажите эффекты, которые обусловливают эту поляризацию. Чем донорно-акцепторная связь отличается от ковалентной? Приведите примеры. Покажите структуру азотной, серной и фосфорной кислот с учетом электронных эффектов. 23. Представьте основные классы неорганических соединений. |
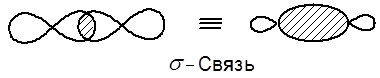 ;
; 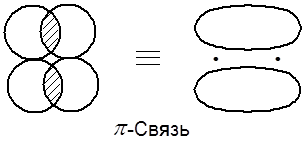
 ;
;