| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 16.02.11 14:05 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 8 из 12
Если в раствор, например, ацетатного буфера попадает соляная кислота, то она нейтрализуется слабым основанием – ацетатом натрия:
Образующаяся слабая кислота – НАс существенно рН среды не изменяет. Введение в буферный раствор сильного основания (NaOH), также не изменит рН раствора, так как ΝаΟΗ будет нейтрализован уксусной кислотой:
Естественно, при ограниченном объеме буферного раствора и, следовательно, при ограниченных количествах имеющихся в нем кислотного и основного компонентов введение кислот или оснований извне без изменения рН раствора имеет свой предел. Существует понятие буферной емкости раствора. Буферная емкость – это количество эквивалентов сильной кислоты или сильного основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить рН среды на единицу. Ясно, что введение кислоты понизит рН, а введение щелочи увеличит значение рН. Расчет рН буферного раствора проводится по следующей методике. Допустим, что мы располагаем раствором ацетатного буфера. Источником протонов в системе является кислота НАс
Ка = Учитывая тот факт, что кислота НАс диссоциирует очень слабо, а соль NaAc как сильный электролит диссоциирует практически полностью, можно допустить, что концентрация ионов Ас– равна концентрации NaAc . Тогда выражение Ка приобретает вид: Ка =
Если [НАс] = [NaAc], то Рассуждая аналогично при вычислении рН буферных смесей, состоящих из слабых оснований и их солей, получим: p OH = pKв – При равенстве концентраций компонентов: р ОН = рКв; рН= 14 – рОН. В случае аммонийного буфера:
Контрольные задания (122-141) (табл. 3.3) Таблица 3.3 Определите рН буферных растворов
Продолжение табл. 3.3
Примечание: Для упрощения расчетов значения рКа, рКв округлены. Бензойная кислота (НВnz): рКа = 4,2; синильная кислота: рКа = 9; угольная кислота: 3.3. Гидролиз солей Гидролиз солей (как и других субстратов) – это обменное взаимодействие (химическая реакция) с водой как с реагентом. В случае солей гидролиз – это по сути реакция, обратная реакции нейтрализации кислот и оснований. Ионы соли в растворе взаимодействуют с Гидролиз соли характеризуется степенью гидролиза:
а также константой гидролиза (Кгидр.) и рН среды.
|
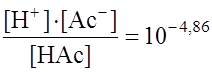 .
.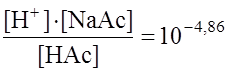 ;
; 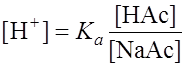 ;
;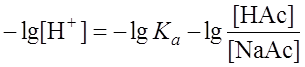 ;
; 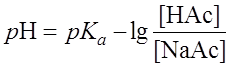 .
.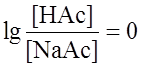 , а рН = рКа = 4,86.
, а рН = рКа = 4,86.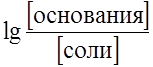 .
.