| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator |
| 16.02.11 14:05 |
|
Страница 4 из 12
2.4. Классификация реагентов и реакций Реагенты подразделяются на электрофильные и нуклеофильные. Электрофильные реагенты – это реагенты, любящие электроны, стремящиеся к минусу. Следовательно, сами они характеризуются дефицитом электронной плотности: а) катионы ( b) Н- и L-кислоты (Н2SО4, ВF3, A1C13 и др.); с) радикалы ( d) поляризованные молекулы ( Нуклеофильные реагенты – реагенты, стремящиеся к плюсу и обладающие, естественно, избыточным отрицательным зарядом или неподеленными парами электронов: a) основания Льюиса ( b) анионы ( c) этилены, ацетилены, бензол и его производные; d) поляризованные молекулы ( Реакции подразделяются по типу реагирующих частиц на гомолитические и гетеролитические. По направлению различают 4 типа реакций – реакции присоединения, отщепления, замещения и перегруппировки. Для анализа химических процессов мы чаще всего будем пользоваться представлениями о двух типах реагентов, четырех типах реакций и двух типах катализа (кислотного и основного). Контрольные задания (24-25) 24. Дайте расширенную характеристику электрофильных и нуклеофильных реагентов. Приведите примеры четырех типов реакций (по направлению) и двух типов по природе реагирующих частиц. 25. Классифицируйте реакции по типу реагирующих частиц и по направлению. Приведите конкретные примеры. Укажите в реакциях электрофильные (Е) и нуклеофильные реагенты (N). 2.5. Жидкие растворы. Электролитическая диссоциация. Электролиты Раствор – это однофазная система, состоящая из двух и более компонентов. Растворы бывают газовыми, жидкими и твердыми. Жидкие растворы, содержащие растворенные вещества в виде сольватированных индивидуальных молекул или продуктов их диссоциации (ионов, радикалов), называются истинными. Существуют также коллоидные растворы (дисперсные системы), в которых растворенное вещество находится в виде мицелл (сольватированных агрегатов атомов или молекул), или в виде сольватированных отдельных макромолекул высокомолекулярного соединения (крахмала, белка и др.). Поясните механизм физико-химического процесса растворения вещества. Какие факторы обусловливают растворимость в воде ионного соединения ( Что такое электролитическая диссоциация и чем она обусловлена? Чем электролиты отличаются от неэлектролитов и что такое степень диссоциации ( 2.6. Теория кислот и оснований Представления об ассоциации и диссоциации веществ в растворах приводят нас к фундаментальным понятиям: кислоты и основания. Уясните, как изменяется характер диссоциации гидроксида элемента в зависимости от положения последнего в периодической системе? Сравним два различных по природе гидроксида:
Ясно, что в водном растворе диполи молекул воды будут атаковать, прежде всего, наиболее полярные связи, соответственно Согласно теории электролитической диссоциации кислоты диссоциируют в растворе с образованием совальтированных (в водной среде – гидратированных) протонов, а основания – с образованием сольватированных гидроксид-анионов. Эти равновесные процессы характеризуютсяконстантами диссоциации – соответственно Ка и Кв – или отрицательными логарифмами этих величин – рКа и рКв (индексы а и в – от англ. Asid – кислота; base – основание). Соотношение концентраций ионов Н+ и ОН– в водных растворах определяется ионным произведением воды:
Следовательно, в нейтральной среде:
Для любого раствора кислоты или основания рН + рОН =14 В случае кислой среды рН<7, а для щелочной среды рН>7. Протогенные растворители: вода, аммиак, спирты, кислоты и др. – склонны к автопротолизу:
Согласно теории Льюиса кислоты – это вещества, молекулы которых содержат атомы с вакантной(ыми) орбиталью(ями), способной принимать пару электронов от донора электронов (основания Льюиса).
2.7. Моль как мера количества вещества. Моль – это количество вещества, которое содержит 6,02·1023 (число Авогадро) структурных единиц (атомов, молекул, ионов, электронов, связей, эквивалентов и др.). Масса одного моля, выраженная в г или кг, называется молярной массой. Так, для серной кислоты М = 98 г/моль, для КОН М = 56 г/моль. Важным является понятие эквивалента вещества. Это реальная частица, или формульная единица, или же ее часть, эквивалентная одному протону (в кислоте), или гидроксид-аниону (в основаниях), или одному электрону (в окислительно-восстановительных реакциях), или одной валентности (в реакциях обменного взаимодействия и присоединения). Масса одного моля эквивалента вещества выраженного в г или кг, называется эквивалентной массой. Массы реагирующих веществ пропорциональны их эквивалентным массам (закон эквивалентов, Дальтон). Эквивалентная масса Н2SО4 в условиях ее полной нейтрализации равна 49 г, а фактор эквивалентности – 1/2. Эквивалентная масса КОН равна малярной массе – 56 г. Важной характеристикой растворов и других многокомпонентных систем является концентрация вещества. В лабораторной практике чаще всего используются следующие формы ее выражения: 1. Процентная концентрация (массовая доля 2. Молярная концентрация – количество молей растворенного вещества в литре раствора (С, моль/л). 3. Эквивалентная концентрация (нормальность) – выраженное в молях количество эквивалента, содержащееся в одном литре раствора (N, моль/л), например, 0,1 моль 1/2 Na2S2O3 (то есть эквивалента Na2S2O3) в 1 л. Для упрощения восприятия мы в ряде случаев будем использовать наименование N экв/л. 4. Титр – масса вещества, растворенного в 1 мл раствора (Т, г/л). Для работы с газообразными реагентами или продуктами реакции важно помнить некоторые константы и закономерности, характеризующие состояние газа. Согласно закону Авогадро 1 моль любого газа при нормальных условиях (0oС, или 273оК; давление 101,325 кПа, или 1 атм.) занимает объем 22,4 л (молярный объем). При постоянной температуре давление, производимое данной массой газа, обратно пропорционально его объему (закон Бойля-Мариотта):
При постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре (Т) (закон Гей-Люссака):
|
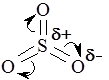 ,
, 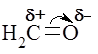 ).
).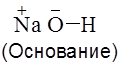
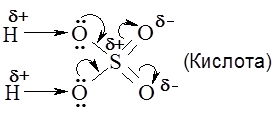
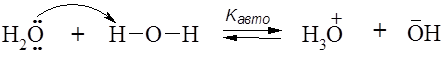
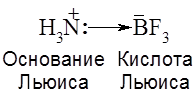 (донорно-акцепторная связь)
(донорно-акцепторная связь)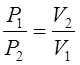 , или
, или 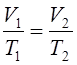 , или
, или 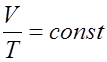 .
.


