| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16.02.11 14:05 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 2 из 12
Продолжение табл. 1.1
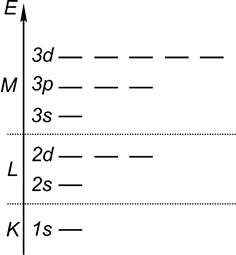
2. От атома – к молекуле 2.1. Строение и общая характеристика атомов Химия изучает строение, свойства и закономерности превращений, обусловленных пререраспределением электронов между взаимодействующими атомными и молекулярными частицами. По этой причине важно установить связь между строением атомов каждого элемента и его положением в таблице Д.И. Менделеева. Ядро состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны – отрицательно. Вокруг ядра вращается столько электронов, имеющих, как известно, отрицательный заряд, сколько содержится протонов в ядре. Электроны располагаются слоями, называемыми энергетическими уровнями (K, L, M и т.д.). Последние, в свою очередь, подразделяются на подуровни (s, p, d, f) (рис. 2.1).
Рис. 2.1. Энергетическая диаграмма первых трех атомных В первом слое – одна орбиталь (1s); во втором – два подуровня (s, p) и четыре орбитали (2s, 2px, 2 py, 2pz); в третьем слое – 3 подуровня (s, p, d) и 9 орбиталей. Таблица Д.И. Менделеева – это последовательность элементов, в которой атом каждого последующего элемента содержит на один электрон больше, чем атом предыдущего. Номер главной подгруппы, к которой относится элемент, указывает на количество электронов на последнем энергетическом уровне атома. Номер же периода укажет нам, каким по счету от ядра является этот энергетический уровень. В плане фундаментальной теоретической подготовки важно научиться “читать” таблицу Д.И. Менделеева, несущую в себе информацию не только о строении атомов, но и об их валентных возможностях, о природе образуемых ими связях, способности принимать и отдавать электроны (то есть об окислительно-восстановительных свойствах), о соотношении металлических и неметаллических свойств. Особое внимание следует обратить на общие признаки и различия в строении и свойствах атомов элементов, родственных по группам: кислород – сера, азот – фосфор, фтор – хлор, углерод – кремний и т.д. Метод сравнения создает предпосылки для развития логического мышления. Контрольные задания (1-16) (табл. 2.1) 1-16. Представьте в виде электронных диаграмм строение атомов, указанных в вашем задании. Дайте сравнительную характеристику указанных элементов, относящихся к одной группе или периоду, а именно: валентных возможностей (на примерах конкретных соединений), энергии ионизации, сродства к электрону, электроотрицательности, окислительно-восстановительных свойств. Таблица 2.1
2.2. Теория химической связи Электроны внешнего слоя атома, которые участвуют в образовании связей, и соответствующие атомные орбитали, на которых они находятся, называются валентными. Заметим, однако, что у переходных элементов (побочных подгрупп) в образовании связей могут быть задействованы электроны и орбитали предпоследнего слоя. Атомная орбиталь – (АО) – это область околоядерного пространства, в которой наиболее вероятно пребывание одного или двух электронов с антипараллельными спинами (электромагнитными векторами ( Атомная орбиталь характеризуется формой, осью симметрии, направленностью в пространстве и энергией. s-Орбиталь имеет форму шара, р -орбиталь – форму гантели (восьмерки), а d-орбиталь – форму четырехлепесткового цветка.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||