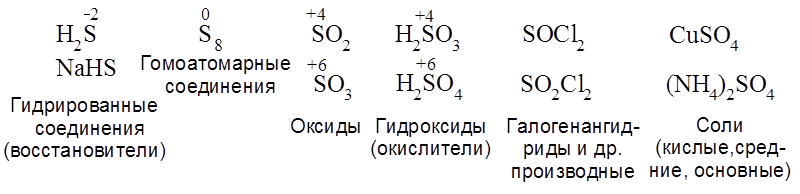| Методические указания по изучению неорганической химии и контрольные задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator |
| 16.02.11 14:05 |
|
Страница 11 из 12
5. ХИМИЯ ЭЛЕМЕНТОВ
Общий план рассмотрения химии каждого элемента следующий. 1. Представьте электронные диаграммы атомов и дайте сравнительную характеристику родственных по группе элементов, прежде всего, валентных возможностей и степеней окисления данных элементов. Основное внимание при сравнении уделить элементам 2-го и 3-го периодов. 2. Покажите ряд важнейших соединений, в котором степень окисления элемента постепенно повышается, а именно: от гидрированных (восстановленных) форм – к предельно окисленным. Например, для серы такой ряд имеет вид:
3. Дайте характеристику электронного и пространственного строения, кислотно-основных свойств и реакций основных соединений. 4. Представьте типичные окислительно-восстановительные реакции соединений данного элемента. 5. Покажите способы получения наиболее важных соединений. 6. Представьте нахождение в природе, практическое применение и биологическую роль некоторых соединений данного элемента. Контрольные задания (181-202) 181. Элементы подгруппы IА. Покажите, как изменяются свойства щелочных металлов при движении в подгруппе сверху вниз: размер атома, энергия ионизации, электроотрицательность, способность к окислению, отношение к водороду и кислороду. Гидриды, оксиды, пероксиды, супероксиды, гидроксиды и соли. Реакции металлов с Н-кислотами. Нахождение в природе. Калийные удобрения. К и Na в почве и в живой клетке. 182. Элементы подгруппы IIА. Покажите, как изменяются характеристики металлов при движении по подгруппе сверху вниз (размер атома, энергия ионизации, электроотрицательность, способность к окислению, отношение к водороду и кислороду. Гидриды, оксиды, пероксиды, гидроксиды и соли. Нахождение в природе. Са и Мg в почвах и в живой клетке. Биологическая роль. 183. Элементы подгруппы IIIА. Дайте общую характеристику, в частности, соотношения неметаллических и металлических свойств. Сравните валентные возможности бора и алюминия. Представьте основные соединения бора и их реакции. Нахождение в природе и биологическая роль соединений бора. 184. Дайте общую характеристику строения и валентных возможностей бора и алюминия. Основные соединения алюминия и их реакции. Амфотерность оксида и гидрооксида. Гидриды и галогениды алюминия. Нахождение в природе, биологическая роль, практическое применение соединений алюминия. 185. Дайте сравнительную характеристику строения и валентных возможностей атомов углерода и кремния. Покажите химию некоторых соединений углерода: СН 4, СО, СО2, CS2 , угольной кислоты и ее производных. Фосген, мочевина. Практическое применение наиболее важных соединений. 186. Дайте сравнительную характеристику строения атомов и валентных возможностей углерода и кремния. Представьте наиболее важные соединения кремния и их реакции. Покажите их нахождение в природе, биологическую роль и практическое применение. Силикагель, стекло, 187. Дайте сравнительную характеристику элементов VА и, в частности, азота и фосфора. Представьте ряд наиболее важных соединений азота в порядке повышения его степени окисления. Покажите электронную и пространственную конфигурацию оксидов и гидроксидов азота азота. Кислотные и основные свойства. Какие электронные факторы их обусловливают? Окислительно-восстановительные свойства соединений азота. Реакция НNO3 с переходными металлами. Нахождение в природе. Азотные удобрения. Биологическая роль соединений азота. Нитриты и нитраты в с/х продуктах. 188. Дайте сравнительную характеристику азота и фосфора. Валентные возможности и степень их окисления. Представьте ряд основных кислородсодержащих соединений фосфора (оксидов и гидроксидов). Обоснуйте с точки зрения электронных эффектов силу кислот (H 3PO3, H3PO4) по трем ступеням диссоциации. Полифосфорные кислоты. Галогениды фосфора и др. производные фосфорной кислоты. Фосфорные удобрения. Нахождение в природе и биологическая роль соединений фосфора. 189. Элементы подгруппы VIА – общая характеристика. Сравните валентные возможности и степени окисления кислорода и серы в соединениях. Представьте важнейшие соединения кислорода: оксиды, гидроксиды (кислотные, основные, амфотерные), пероксиды, супероксиды. Вода: Кдис., ионное произведение. Покажите связь силы кислот и оснований с электронными эффектами в молекулах. Пероксид водорода, супероксид калия, озон. Окислительно-восстановительные реакции. Нахождение в природе и биологическая роль кислорода и некоторых его соединений. 190. Дайте сравнительную характеристику элементов подгруппы VIА, в частности, валентных возможностей и степеней окисления кислорода и серы. Представьте важнейшие соединения серы в порядке повышения ее степени окисления. Сероводород – кислотные свойства. Оксиды и гидроксиды серы. Покажите связь кислотных свойств гидроксидов с электронными эффектами в молекуле. Галогенангидриды и амиды серной кислоты. Дисерная кислота. Окислительно-восстановительные реакции H2S, S8, SO2, SO3, H2SO4. Нахождение в природе и биологическая роль соединений серы. Сульфитирование соков и вин. 191. Дайте общую характеристику элементов подгруппы VIIА при движении сверху вниз. Сравнительная характеристика валентных возможностей фтора и хлора в связи со строением их атомов. Представьте основные соединения фтора и их реакции. Фтор и хлор как окислители. Фтористый водород и хлористый водород. Окисление HCl. Хлорная известь – получение, гидролиз, определение содержания активного хлора. Нахождение в природе и биологическая роль соединений фтора. 192. Дайте сравнительную характеристику элементов подгруппы VIIА и полную характеристику хлора. Гомолиз молекулы хлора и некоторые его радикальные реакции. НСl и кислородсодержащие кислоты хлора со степенью окисления +1, +3, +5, +7 (гипервалентные соединения хлора). Оксид хлора. Дайте обоснование силы кислот с позиции электронных эффектов. Причины диссоциации кислот. Галогенангидриды кислот (хлориды серы и фосфора) и их гидролиз. Хлорная известь (получение, практическое использование и гидролиз). Определение активного хлора в хлорной извести. Получение и практическое применение хлора и его соединений. Нахождение в природе, биологическая роль. Альтернатива хлорированию воды. 193. Дайте общую характеристику инертных (благородных) газов (подгруппа VIIIА). Изменение их свойств при движении по подгруппе сверху вниз. Соединения некоторых элементов подгруппы криптона, в частности, ксенона. Нахождение в природе, практическое применение. 194. Дайте общую характеристику переходных элементов. Изложите общие представления об электронном и пространственном строении комплексных соединений (КС). Номенклатура. Приведите примеры линейных, тетраэдрических и октаэдрических КС с координационным числом 2, 4, 6 и назовите их. Константы стойкости и нестойкости КС. Практическое использование и биологическая роль координационных соединений. Металлоферменты. Покажите структуру комплексов: 1) кальция с динатриевой солью этилендиаминтетрауксусной кислоты (ЭДТА, трилоном Б); 2) порфиринатов железа и магния. 195. Дайте общую характеристику металлов подгруппы IВ: меди, серебра и золота. Реакции окисления и комплексообразования. Приведите наиболее важные соединения. Реакция серебряного зеркала как модель биологического окисления. Нахождение в природе, практическое применение, биологическая роль. Медный купорос. Бордосская жидкость. 196. Дайте общую характеристику элементов подгруппы IIВ: цинк, кадмий, ртуть. Химические свойства. Отношение к кислотам и щелочам. Реакции окисления и комплексообразования. Покажите нахождение в природе, практическое применение и биологическая роль. 197. Дайте общую характеристику металлов подгруппы VIВ: хрома, молибдена, вольфрама, – а также марганца. Основные соединения. Окислительно-восстановительные реакции. Охарактеризуйте нахождение в природе, практическое применение и биологическую роль. 198. Дайте общую характеристику металлов подгруппы VIIIВ (семейств железа и платиновых металлов). Отношение к окислителям. Покажите основные соединения. Окислительно-восстановительные реакции и комплексообразование. Представьте нахождение в природе, практическое применение и биологическую роль указанных металлов. 199. Понятие о радиоактивных элементах. Типы радиоактивного распада. Дозы облучения и их влияние на биологические объекты. Практическое применение процессов, связанных с радиоактивным распадом и ядерным синтезом. 200. Дайте общую характеристику окислительно-восстановительных реакций. Назовите типичные окислители и восстановители различных элементов таблицы Д.И.Менделеева, в частности, кислорода, азота, серы, галогенов и др. Приведите характерные реакции. Охарактеризуйте в общих чертах цепные радикальные реакции. Приведите примеры радикалов и их химических превращений. 201. Понятие о термодинамике и кинетике химических процессов. Функции состояния системы: внутренняя энергия (U), энтальпия (H), энтропия (S), свободная энергия Гибса (G). Первое начало термодинамики. Стандартная энтальпия (теплота) образования – Энтропия как мера неупорядоченности системы. Второе начало термодинамики. Скорость химической реакции и влияющие на нее факторы. Константа скорости реакции. Порядок реакции по реагенту. Активированный комплекс. Энергия активации. Катализ. Химическое равновесие. Принцип Ле-Шателье. 202. Сформулируйте общие представления о растворах. Растворы истинные и коллоидные. Факторы определяющие растворимость веществ. В каком виде существует в растворе растворенное вещество: а) ионное, сильнополярное (НСl, Н2SO4); б) вещество с ковалентными связями (С2Н5ОН, сахароза, глицерин); в) высокомолекулярное соединение (крахмал, казеин (белок))? Константы автопротолиза, диссоциации, ассоциации.Кдисс. воды, ионное произведение воды, константы диссоциации кислот и оснований (Ка, Кв, рКа, рКв,). Назовите основные кислоты и основания (щелочи). Дайте обоснование силы кислоты, например, Н2 SО3, Н2SO4 с позиций представлений об электронных эффектах. Как определить рН раствора? Используя закон эквивалентов, определите содержание (концентрацию) кислоты в растворе титрованием его аликвоты стандартным раствором щелочи в присутствии индикатора (метилоранжа, фенолфталеина). И, наоборот, определите концентрацию щелочи в растворе, титруя соответствующую аликвоту стандартным раствором кислоты. Оперируйте произвольными цифрами в стиле деловой игры.
|