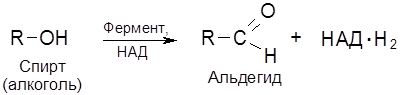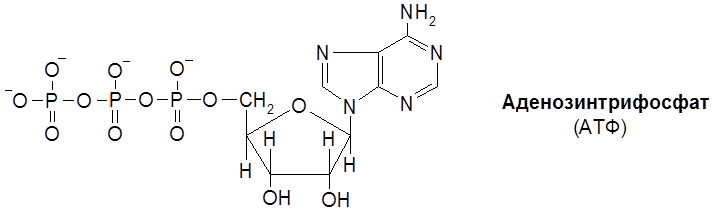| МЕТОДИЧЕСКИЕ УКАЗАНИЯ по изучению биологической химии и задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator |
| 16.02.11 13:09 |
|
Страница 6 из 19
3.3. Классификация и номенклатура ферментов
Классификация и номенклатура ферментов основывается на природе химических превращений. Выделяют шесть главных классов ферментов: 1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции. 2. Трансферазы – контролируют реакции межмолекулярного переноса групп атомов. 3. Гидролазы – обеспечивают реакции гидролитического расщепления химических связей. 4. Лиазы – катализируют реакции негидролитического расщепления, присоединения групп по двойной связи и обратные реакции отщепления таких групп. 5. Изомеразы – контролируют реакции изомеризации. 6. Лигазы (синтетазы) – катализируют реакции соединения двух молекул, сопряженные с расщеплением связей Р–О в молекулах АТФ или нуклеозидтрифосфата. Классы разделяются на подклассы. Так, оксидоредуктазы классифицируются по природе окисляемой группы в субстрате (спиртовой С–ОН, альдегидной СНО, аминогруппы С–NH2 и др.) Трансферазы классифицируются согласно транспортируемых групп атомов (ацильных, азот-, фосфор-, серосодержащих групп и т.д.). Гидролазы подразделяются по типу гидролизуемых связей (эфирных, пептидных, амидных и др.). Лиазы идентифицируются по природе подвергающихся разрыву связей (С–О-лиазы, С–N-лиазы, С–С-лиазы и др.). Изомеразы различают по типу реакции изомеризации (цис-/транс-изомеризация, рацемизация и др.), а лигазы – по природе вновь образующихся связей. В свою очередь, каждый подкласс делится на подподклассы, названия которых детализируют природу ферментативной реакции. Краткие названия некоторых распространенных групп ферментов и их функции (отмечены в скобках) формулируются следующим образом. 1. Дегидрогеназы (дегидрирование субстратов). 2. Оксидазы (окисление субстратов кислородом). 3. Гидроксилазы (введение группы ОН с помощью О2). 4. Оксигеназы (включение молекулы кислорода при расщеплении С–С-связи). 5. Киназы (перенос фосфатной группы на субстрат от АТФ). 6. Трансферазы (перенос определенных групп). Так, трансацетилаза переносит ацетильный радикал, транскарбоксилаза переносит карбоксильную группу и т.д. Покажем названия ферментов на примерах следующих реакций. 1. Шифр фермента – КФ 1.1.1.1. Систематическое название – алкоголь: НАД-оксидоредуктаза. Тривиальное название – алкогольдегидрогеназа. Ферментативная система работает по принципу “замок-ключ” (к замку подходит только ключ со строго определенной конфигурацией). Геометрические параметры белкового окружения реакционного центра фермента таковы, что в эту нишу укладывается молекула субстрата со строго определенным пространственным строением (матричный эффект). Известна относительная групповая специфичность. Так, липазы и эстеразы расщепляются не только триацилглицеролы (жиры), но и диацилглицеролы, моноацилглицеролы, другие сложные эфиры. А пептидазы расщепляют пептидные связи в различных полипептидах и белках. Особое значение имеет стереохимическая специфичность ферментов. Например, фумарат-гидратаза (L-малат-гидролиаза) катализирует превращение только фумарата, имеющего, как известно, транс-конфигурацию. Хотя существуют и ферменты, действующие как на цис-, так и транс-изомеры. 3.4. Коферменты Можно выделить три группы кофаторов: 1) Специфические коферменты, или коэнзимы – низкомолекулярные органические соединения, обратимо связывающиеся с белками ферментов (апоферментами). 2) Простетические группы – коферменты, прочно связывающиеся с апоферментом, как правило, за счет ковалентных связей. 3) Активаторы – неспецифические вещества, способствующие повышению каталитической активности ферментов. Особое место среди коферментов первой группы в классе оксидоредуктаз занимают коферменты, в состав которых входит ион металла и порфириновое ядро. Магниевый комплекс замещенного порфирина – хлорофилл – принимает участие в фотосинтезе углеводов. А соответствующий комплекс с Fe (ІІ) – гем – служит коферментом для белков (гемоглобина, миоглобина), осуществляющих перенос кислорода в процессе дыхания. Вторую группу коферментов составляют переносчики групп атомов, связанные с ферментами класса трансфераз: нуклеозидфосфаты (аденозинтрифосфат, или АТФ, уридиновые нуклеотиды), кофермент А (КоА). Аденозинтрифосфат (АТФ) является макроэргическим (то есть богатым энергией) аккумулятором биологической энергии:
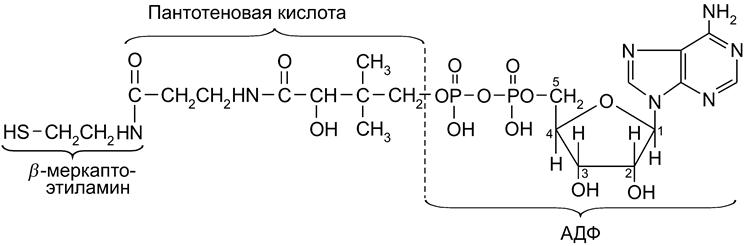
Переносчиками групп в ферментативных реакциях субстратов, содержащих альдегидную и ацильную группы, являются ЦДФ-холин и ЦДФ-этаноламин. В обмене углеводов важную роль играют уридиннуклеотидные коферменты. В качестве переносчика ацильных фрагментов в реакциях ацилирования и поставщика ацетильного радикала (
Ацильные радикалы локализуются на группе SH кофермента (
|