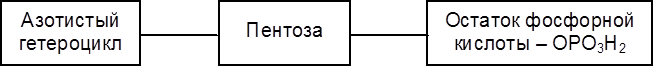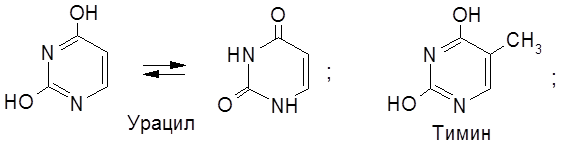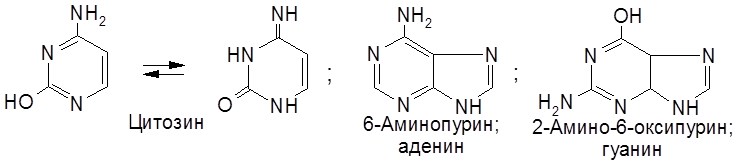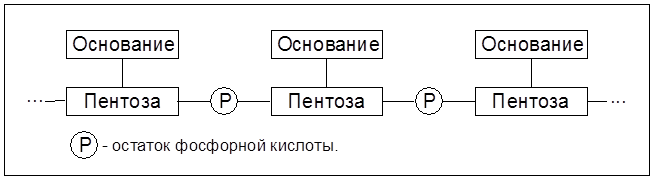| МЕТОДИЧЕСКИЕ УКАЗАНИЯ по изучению биологической химии и задания для самостоятельной работы |
 |
 |
| Добавил(а) Administrator |
| 16.02.11 13:09 |
|
Страница 16 из 19
7.3. Структура и классификация белковСтруктура белка определяется наличием многих типов связей и слабых взаимодействий внутри макромолекул и между молекулами. Существует понятие о четырех уровнях структуры белков. В зависимости от формы и конформации макромолекул они разделяются на глобулярные и фибриллярные. Глобулярные белки имеют шарообразную или эллипсоидную форму молекул. Фибриллярные белки состоят из вытянутых нитевидных молекул. К этой группе относятся белки мышц (миозин), волос (кератин), шелка (фиброин). По составу и физико-химическим свойствам белки разделяют на простые (протеины) и сложные (протеиды). Протеины при гидролизе дают только аминокислоты. В случае же протеидов при гидролизе образуются наряду с аминокислотами вещества небелковой природы, называемые простетическими группами. В состав молекулы гемоглобина (М = 60.000-70.000) входит белок глобин, состоящий из четырех полипептидных цепей, и простетическая группа гем – хелатный комплекс железа (II) и макроцикла протопорфирина. 7.4. Биосинтез и обмен аминокислот в растительных организмах Для большинства видов растений источником азота являются аммиак и нитраты почвы. Лишь некоторые из растений способны усваивать непосредственно молекулярный азот и превращать его в азотистые вещества. Источником аммиака в почве являются остатки и выделения животных и растений, разлагающихся в почве под влиянием микроорганизмов. В растительных и животных организмах реализуется широкий набор ферментативных превращений одних аминокислот в другие. Механизм синтеза белка на основе аминокислот в растительных клетках во многом сходен с механизмом этого процесса в животных организмах. 7.5. Особенности метаболизма белков и аминокислот в животных организмах Гидролитическое расщепление эндогенных (локализованных внутри) и экзогенных (поступающих извне) белков осуществляется протеолитическими ферментами – пептидгидролазами (подкласс КФ 3.4). Выделяющаяся при этом энергия переходит в тепло. Эндопептидазы расщепляют пептидные цепи, действуя на центральные участки, а экзопептидазы отщепляют концевые аминокислоты. На первом этапе катаболизма белки проходят сложный путь протеолитических превращений в желудочно-кишечном тракте. В желудке животных и человека белки набухают, разрыхляются и денатурируют под действием желудочного сока, содержащего 0,8% соляной кислоты и других активных компонентов. Затем в действие вступают эндогенные протеолитические ферменты – пепсины и химозин. Белки и пептиды попадают из желудка в тонкий кишечник, где под действием протеиназах подергаются более глубокому гидролизу. Не гидролизированные в тонком кишечнике белки поступают в толстый кишечник, где они подвергаются гниению. В этом процессе ферменты бактерий осуществляют расщепление белков и аминокислот, сопровождающееся образованием газов (метана, СО2, Н 2S) и токсических веществ (фенола, крезола, скатола, индола и др.). Механизм всасывания аминокислот и низкомолекулярных пептидов связан с их транслокализацией через мембраны клеток с помощью специфических переносчиков. Превращения белков внутри клеток и в межклеточном пространстве органов и тканей осуществляются, как уже отмечалось, комплексом пептидгидролаз ( катепсинами), локализированным в цитоплазме либо на мембранах. Белки в организме постоянно обновляются. Так, белки печени обновляются наполовину за 8-12 суток, белки плазмы крови – за Взаимопревращения аминокислот в процессе обмена в животных организмах основаны на реакциях трансаминирования, дезаминирования (в том числе – окислительного дезаминирования), декарбоксилирования и др. Известен ряд форм выводимого из организма азота: аммиак, мочевина, креатинин, индикан, скатол и индол. Фенол, крезол, индол и скатол – ядовитые вещества с неприятным запахом – всасываются в кровь и при избытке оказывают вредное воздействие на организм. В животных организмах от аминокислот берут начало белки, в том числе ферменты, гормоны, антитела, пиримидиновые и пуриновые основания, необходимые для синтеза нуклеотидов и нуклеиновых кислот, пиррольные производные (порфирины), множество биологически активных веществ пептидной природы. 7.6. Биосинтез белка. Нуклеиновые кислоты Современная научная концепция биосинтеза белков тесно связана с такими проблемами, как наследственность, естественный отбор, выведение новых форм растительных и животных организмов на основании современных достижений генной инженерии. Синтез белка осуществляется в субклеточных структурах – рибосомах, которые локализуются в цитоплазме, митохондриях и хлоропластах. Процесс образования белковых молекул осуществляется по принципу матричного синтеза с помощью нуклеиновых кислот. Нуклеиновые кислоты (полинуклеотиды) представляют собой продукты конденсации мононуклеотидов, состоящих из трех компонентов:
Соединение, включающее два первых компонента – гетероцикл и пентозу – называется нуклеозидом. Таким образом, нуклеотид – это фосфорный эфир нуклеозида. К нуклеозидному фосфату могут присоединяться еще один или два остатка фосфорной кислоты, образуя соответственно нуклеозидди- и нуклеозидтрифосфаты. В состав нуклеотидов и нуклеиновых кислот включены три пиримидиновых основания (урацил, тимин, цитозин) и два пуриновых основания (аденин и гуанин).
Из пентоз в состав рибонуклеиновой кислоты (РНК) включены рибоза, а в дезоксирибонуклеиновую кислоту – дезоксирибоза. Звено Соединение мононуклеотидов посредством эфирных связей фосфорной кислоты приводит к образованию нуклеиновых кислот, принцип построения которой отражает схема 7.1.
Схема 7.1. Стуктура одноцепочечной нуклеиновой кислоты 7.6.1. Механизм биосинтеза белка В соответствии с матричной теорией биосинтеза белка можно выделить следующие его стадии: транскрипция, рекогниция и трансляция. Транскрипция (от лат. transсriptio – переписывание) заключается в том, что на матрице каждой их двух цепей раскручивающейся двойной спирали ДНК в ядре осуществляется синтез аналога рибонуклеиновой кислоты, именуемого матричной (ядерной) РНК. Информационные РНК отделяются от ядра и переходят в протоплазму, где они локализуются на рибосомах и осуществляют поликонденсацию аминокислот, то есть трансляцию (от лат. translatio – перенесение) кода ДНК на структуру белковых молекул. Однако трансляции предшествует стадия рекогниции (от лат. recognition – узнавание, опознание), суть которой состоит в подготовке к введению в процесс поликонденсации молекул аминокислот в строго определенной последовательности. Включение каждой из 20 аминокислот в полипептидную цепь на стадии трансляции обеспечивает так называемый кодон – триплет, состоящий из трех нуклеотидов в цепи м-РНК. Стадию трансляции матричной (информационной) РНК в полипептидную последовательность аминокислот можно также разделить на 3 стадии: инициацию; элонгацию (удлинение) и терминацию (завершение роста цепочки полимера).
|