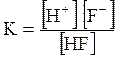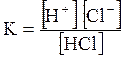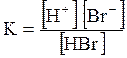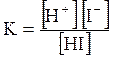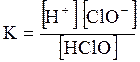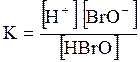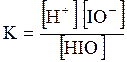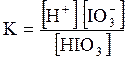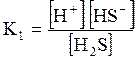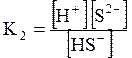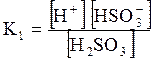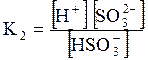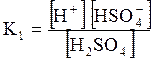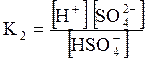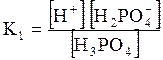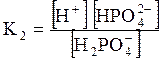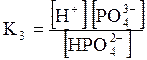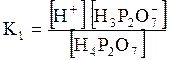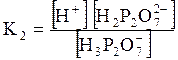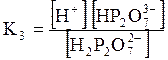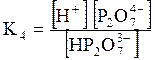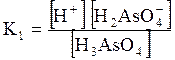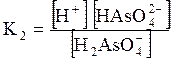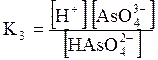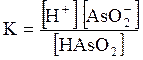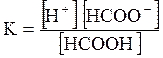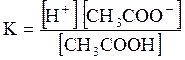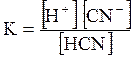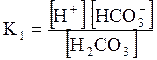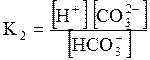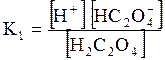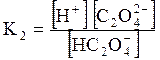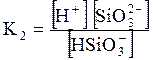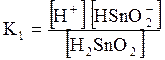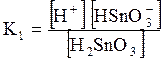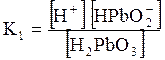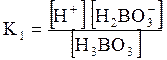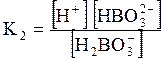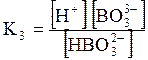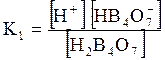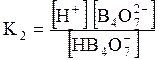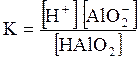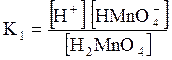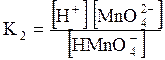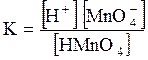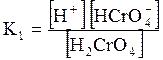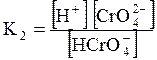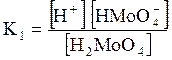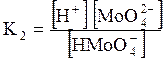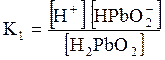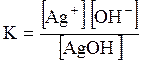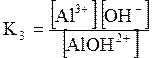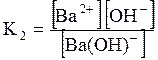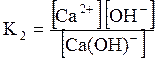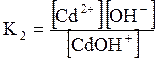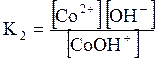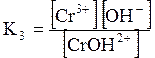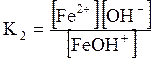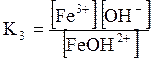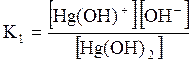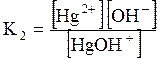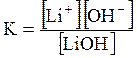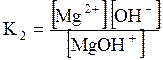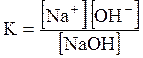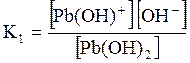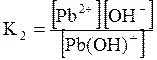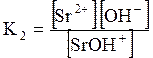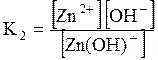| МЕТОДИЧНІ ВКАЗІВКИ З курсу загальної, неорганічної і біонеорганічної хімії Для виконання завдань із самостійної роботи |
 |
 |
| Учебники методички лекции рабочие программы - Методички, методические указания | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27.11.11 19:43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 5 из 5
8. Для наведених координаційних сполук: Зазначити: · іон-комплексоутворювач, ліганди, зовнішню та внутрішню координаційні сфери; · класифікацію координаційних сполук згідно із зарядом внутрішньої координаційної сфери та природою лігандів; · назву координаційних сполук відповідно до сучасної номенклатури. Визначити: · ступінь окиснення та координаційне число іона-комплексоутворювача; · заряд комплексного іона. Скласти: · рівняння дисоціації координаційних сполук; · вираз константи нестійкості комплексного іона. Приклад: [Ni(NH3)6]SO4. Ni2+ - іон-комплексоутворювач; 6 NH3 – ліганди; Комплексна сполука катіонного типу; назва – сульфат гексааміннікелю (ІІ);
8.1. [Co(NH3)6](NO3)3, Na3[AlF6]; 8.5. Fe3[Fe(CN)6]2, [Cu(NH3)4]SO4; 8.2. [Ag(NH3)2]Cl, K3[Fe(CN)6]; 8.6. [Zn(NH3)4]Cl2, K2[Cu(CN)4]; 8.3. K3[FeF6], [Co(NH3)6]3(PO4)2; 8.7. Zn2[Fe(CN)6], [Co(H2O)6]Br2; 8.4. K[Sb(OH)6], [Cd(NH3)4](OH)2; 9. Написати рівняння реакцій утворення комплексних сполук: Див. приклад №6. 9.1. BF3 i HF; 9.5. Fe(CN)2 i HCN; 9.2. AgCl i HCl; 9.6. PtCl4 i HCl; 9.3. Ni(OH)2 i NH3; 9.7. Cu(OH)2 i NH3. 9.4. SiF4 i HF; 10. Дописати рівняння реакцій. Вказати, до якого типу відноситься реакція: Приклад:
10.1. K2[CuCl4] + NH3(надл.) ® 10.2. Fe3+ + [Fe(CN)6]4 - ® 10.3. Fe2+ + [Fe(CN)6]3 - ® 10.4. [Co(NO2)6]3- + K+ ® 10.5. Cu(OH)2 + Na2SO3 (надл.) ® [Cu(SO3)]6- + ... 10.6. [Ni(NH3)6]SO4 + NaOH(надл.) ® Ni(OH)2 + ... 10.7. CoSO4 + NaNO2 + CH3COOH ® Na3[Co(NO2)6] + NO + ... 4.ХіміЯ елементів головних та побічних підгруп на прикладі найважливіших біогенних елементів. Що треба знати: Ø Особливості електронної будови атомів біоелементів; Ø Типові ступені окиснення біоелементів (згідно з електронно-графічною схемою); Ø Формули найважливіших кисневих, безкисневих, водневих сполук; Ø Хімічні властивості сполук біоелементів; Ø Способи і стадії одержання хлоридної, сульфатної, нітратної, фосфорної кислот; Ø Хімічні властивості кислот-неокисників і кислот-окисників (HNO3(конц), H2SO4(конц)). Ø Мінеральні добрива. Що треба вміти: Ø Складати електронні та електронно-графічні формули елементів; Ø Визначати валентність і ступені окиснення елементів (усі можливі); Ø Складати формули оксидів, кислот і солей; Ø Писати рівняння реакцій, які підтверджують хімічні властивості; Ø Складати рівняння реакцій одержання найважливіших мінеральних добрив; Ø Складати рівняння реакцій, що характеризують окисно-відновні властивості елементів у їх сполуках. Про що треба мати уявлення: Ø Бром, аналог хлору; Ø Селен, аналог сірки; Ø Озон і захисна дія озонового шару атмосфери; Ø Добрива - ціанамід, карбамід, поліфосфати, циклофосфати; Ø Стибій, арсен, вісмут - аналоги фосфору; Ø Сполуки бору. 4.1. Хімія сполук елементів головних підгруп VII, VI, V, IV, III груп (хлор, бром, йод, оксиген, сульфур, нітроген, фосфор, карбон, бор, алюміній). Гідроген і його сполуки. Біологічна роль елементів. Елементи, які вивчаються відіграють велику біологічну роль і мають важливе значення в живленні рослин, тварин і людини. Будова та фізико-хімічні властивості більшості елементів міститься в основній літературі [1,2]. Знання хімічних властивостей і пояснює біологічну роль елементів. Хлор (Сl) в організмі входить до складу червоних кров'яних клітин (еритроцитів), хлороводневої кислоти шлункового соку (0,3 - 0,5% розчин НСl). Шлунковий сік містить багато неорганічних речовин - хлориди, сульфати, фосфати, бікарбонати натрію та калію, кальцію та магнію, амонію й органічні компоненти - сечовина, молочна кислота. При втраті хлору організмом (до 20%) порушується секреція соляної кислоти залозами шлунка, спостерігається важкий стан, що супроводжується судорогами. Рослини засвоюють хлор із ґрунтових розчинів у вигляді хлорид-іонів. Хлорид-іони приймають участь у створенні мембранного потенціалу, який регулює процеси переносу неорганічних і органічних речовин крізь мембрани. Бром (Br) незамінний мікроелемент, міститься в організмах тварин і людини, та в рослинах. NaBr - приймає участь в активації пепсину - ферменту шлункового соку й активізує діяльність інших ферментів. Броміди регулюють функцію центральної нервової системи. Йод (І) - необхідний елемент для забезпечення нормального протікання життєвих процесів. 1/5 частина йоду в організмі людини міститься в щитовидній залозі, він є складовою частиною гормону тироксину. За добу людина потребує 0,15 - 0,3мг йоду. Головним чином, йод потрапляє в організм людини з водою й овочами. Йод здебільшого накопичується у тканинах таких водоростей, як бура водорість, морська капуста - ламінарія та ін. Недостача йоду призводить до захворювання - ендемічного зобу. Оксиген (О) - входить до складу повітря, води, ґрунту, живих організмів, продуктів харчування, одягу та ін. Кисень - основа процесу горіння, сировина для енергетики, металургії, тощо. Сірка (сульфур, S) важливий елемент, який добувають із піриту FeS2 і використовують для виробництва сульфатної кислоти. Сірка міститься у складі деяких білкових речовин тваринного й рослинного походження. Гострий смак і запах часнику, цибулі, хрону й гірчиці обумовлений органічними сполуками сірки. Азот (нітроген, N) входить до складу найважливіших неорганічних сполук - амоніаку, нітратної кислоти, мінеральних добрив - KNO3, NH4NO3, Ca(NO3)2. Фосфор (Р) також елемент-органоген. 90% його в організмі людини міститься у кістках скелета, зубах. Величезне значення фосфор відіграє для живлення рослин у складі мінеральних добрив. Вуглець (карбон, С) - життєво важливий макроелемент. Білки, жири, вуглеводи, гормони, ферменти, вітаміни - є сполуки вуглецю. Тільки СО2 при взаємодії з водою в зеленому листі рослин під дією хлорофілу і сонячного світла призводить до утворення органічних сполук, які є перехідним містком із неживої до живої природи. Кремній (Si) міститься у ґрунті у великих кількостях (33% мас.), але не утворює розчинних сполук, тому в живих організмах його дуже мало. Відноситься до мікроелементів. Біологічна роль кремнію в організмі людини й тварин визначається у підвищенні міцності епітеліальної тканини й тканини з'єднання. В рослинних, злакових і тваринних організмах SiО2 грає опорну роль, особливо для морських нищих тварин (кремнієвий скелет). При надлишку SiО2, який потрапляє в легені з пилом, розвивається захворювання - силікоз (у гірників, робітників пилових професій). Бор (В) неметал більше схожий на кремній, найлегший р-елемент (М = 10,8). В рослинних організмах бор відіграє важливу роль при синтезі і переміщенні вуглеводів, фосфору й стимуляторів росту. Нестача бору в ґрунті призводить до порушення вуглеводно-фосфатного обміну. Надлишок бору в ґрунті викликає захворювання рослин та їх загибель. В організмах тварин і людини бор міститься у складі зубів і кісток. Обмін бору в організмі пов'язаний з обміном калію. При нестачі калію в раціоні тварин затримується їх ріст, додаванням бору цей недолік усувається. Вплив бора на вуглеводний обмін пов'язано з хімічними властивостями борної кислоти, яка активно реагує з полігідроксидсполуками, що мають ОН-групи в Цис-положенні. Сполуки H3BO3 i Na2B4O7·10H2O (бура) відносяться до токсичних для тварин і людини речовин. 2% розчин H3BO3 - смертельна доза для дітей, для дорослого - 15-20мг. Алюміній (Al) - третій з найбільш поширених елементів земної кори. По вмісту в організмах Al відноситься до мікроелементів. В головному мозку Al знаходиться в більших кількостях, ніж інші метали. Це пояснюється впливом Al на центральну нервову систему, збудження якої супроводжується його збільшенням у крові. Уповільнення реакції нервової системи - зниження вмісту Al. Алюміній приймає участь у побудові епітеліальної тканини й сполучної тканини в організмі. Деякі препарати (наприклад, калій-алюмінієві квасці КAl(SО4)2·12Н2О) використовується в лікувальній практиці. Водень (гідроген, Н) - найпоширеніший елемент у Всесвіті. Цей елемент - головне джерело енергії Сонця. В земній корі водень складає 10% мас. з кожних 100 атомів 17 відносяться до водню. Водень входить у склад усіх живих організмів, є складовою частиною води, яка займає 3/4 поверхні земної кулі. Вивчення залежності ходу хімічних процесів від концентрації катіонів водню або рН, є одним із вузлових питань ( рН = - lg[H+]). Складні біохімічні процеси, що протікають в організмі, також обумовлені строго визначеною величиною рН внутрішнього середовища організму - тканинних рідин, крові, соків травлення та ін. Наприклад, рН крові дорівнює 7,36 - 7,42. Зміщення рН крові у людини навіть на 0,1 - 0,2, у порівнянні з нормою, призводить до важких порушень.
4.2. Хімія сполук найважливіших біогенних металів. Метал – макро - і мікроелементи. Необхідний матеріал для засвоєння даної теми міститься в основній літературі [1] і додатково у лабораторному практикумі [5]. Більшість хімічних елементів (80%) відносяться до металів. Фізико-хімічні властивості металів визначаються їх положенням у періодичній системі Д. І. Менделєєва й обумовлюється характерною будовою їх зовнішніх електронних оболонок. Усі метали мають особливість будови атома: на зовнішньому енергетичному рівні знаходиться 1-3 електрона. S-елементи: усі елементи головних підгруп I і II групи - метали. Усі d-, f-елементи - це метали побічних підгруп, лантаноїди й актиноїди. Р-елементи: усі елементи головних підгруп III групи (крім У), IV групи (Sn, Pb), V групи (Sb, Bi), VI групи (Po) - метали. У металів головних підгруп валентні електрони розміщені на зовнішньому енергетичному рівні. Їх максимальний ступінь окиснення дорівнює номеру групи. У металів побічних підгруп іде добудова електронами передостаннього енергетичного шару, тому їх валентні електрони розміщені на останньому й передостанньому енергетичних рівнях. Це "перехідні метали". До біогенних металів відносяться K, Na, Ca, Mg, Cu, Zn, Fe, Co, Mo. З них метали-макроелементи: K, Na, Ca, Mg; метали-мікроелементи: Mg, Cu, Zn, Fe, Co, а також V, Os. Метали - мікроелементи (Mn, Cu, Zn, Fe, Co, V, Os) у надзвичайно малих кількостях містяться в рослинах, але відіграють надзвичайно велике значення - під дією мікродобрив збільшується утворення хлорофілу, зростає інтенсивність фотосинтезу, посилюється діяльність ферментативного комплексу, покращується дихання рослин, підвищується стійкість до хвороб. Усе це призводить до збільшення врожайності. Встановлено, що Mn, Zn, Cu, підвищують коефіцієнт корисного використання променевої енергії світла при фотосинтезі, стимулюють окисно-відновні реакції, що мають велике біологічне значення. Мо, Mn, V, Os - є спеціальними каталізаторами складного процесу фіксації нітрогену повітря мікроорганізмами ґрунту. Mn, Cu, Zn, та інші елементи в ультрамікрокількостях впливають на стан протоплазми, сприяють адсорбційному зв'язуванню вологи. Це позитивно впливає на ріст рослин і підвищує їх стійкість до спеки. Головним джерелом надходження мікроелементів у рослин - є ґрунт. Рослини використовують метали у вигляді іонів або молекул, де метал зв'язаний зі складними органічними лігандами. Нестачу рухливих катіонів металів компенсують внесенням мінеральних добрив. Контрольні завдання: 1. За допомогою яких реакцій можна здійснити такі перетворення: 1.1. KCl ® Cl2 ® KClO3 ® KClO4 ® Cl2 ® KCl; 1.2. I2O5 ® I2 ® HIO3 ® I2; 1.3. Ca3(PO4)2 ® P ® P2O5 ® H3PO4 ® NH4H2PO4; 1.4. S ® H2S ® (NH4)2S ® H2S ® S; 1.5. CaO ® CaC2 ® Ca(OH)2 ® Ca(ClO)2; 1.6. Na ® Na2O2 ® Na2O ® NaOH ® NaHSO4;
NH3 2. Які хімічні реакції необхідно провести, щоб одержати речовину: 2.1. Хлорне вапно: MnO2, HCl, Ca(OH)2; 2.2. Фосфорну кислоту: Ca3(PO4)2, SiO2, C, H2O; 2.3. Нітратну кислоту: NH3, O2, H2O; 2.4. Хлор: NaCl, H2SO4, КMnO4; 2.5. Сульфатну кислоту: FeS2, O2, H2O; 2.6. Простий суперфосфат: Ca3(PO4)2, H2SO4, H2O; 2.7. Преципітат: Ca(OH)2, H3PO4, H2O. 3. Які ступені окиснення виявляє елемент у сполуках: 3.1. Хлор: HClO2, Cl2O, HCl, HClO4; 3.2. Фосфор: P2H4, H3PO2, H3PO3, H4P2O7; 3.3. Йод: I2O5, NaIO3, HIO, H5IO6; 3.4. Азот: NH3, N2O, N2O3, NF3; 3.5. Сірка: Al2S3, Na2S2O3, Na2S4O6, Cu2S; 3.6. Вуглець: CH4, C2H4, CCl4, CO; 3.7. Кисень: H2O2, KClO3, O3, Ba(OH)2. 4. Закінчити рівняння окисно-відновних реакцій: 4.1. P2H4 + K2Cr2O7 + H2SO4 ®; 4.2. HClO4 + P2O3 ®; 4.3. NaJO3 + SO2 + H2O ®; 4.4. KClO3 + H2C2O4 + H2SO4 ®; 4.4. KJ + K2Cr2O7 + H2SO4 ®; 4.5. KNO2 + K2Cr2O7 + H2SO4 ®; 4.6. KMnO4 + K2SO3 + H2O. 5. Закінчити рівняння реакцій і визначити сумарне число коефіцієнтів: 5.1. a) CrCl3 + H2O2 + KOH ®; 5.5.a) PbS + H2O2®; B) CaO + C ®; b) KOH + ClO2 ®; C) H2SO4(конц) + Mg ®; c) Cl2 + HgO ®; 5.2. a) Cu + HNO3(р) ®; 5.6.a) K2Cr2O7 + HCl ®; B) S + H2SO4(конц) ®; b) KClO3+H2C2O4+H2SO4 ®; C) KNO2 + KMnO4 + H2O ®; c) ClO3 + Ca(OH)2 ®; 5.3. a) KMnO4 + Cl2 ®; 5.7.a)FeSO4+HNO3+H2SO4 ®; B) K2Cr2O7 + HCl ®; b) FeS + O2 ®; C) FeCl3 + HJ ®; c) KMnO4 + Cl2 ®. 5.4. a) H3PO3 + AgNO3 + H2O ®; B) H2S + Cl2 ®; C) PbO + Ca(ClO)2 ®; 6. Урівняти рівняння реакцій і визначити, які властивості (окисник чи відновник) проявляє елемент у реакції: 6.1. Хлор: Cl2 + O3 ® Cl2O6 + O2; 6.2. Бром: Br2 + H2O ® HBr + HBrO; 6.3. Сірка: KMnO4 + SO2 + H2SO4 ® MnSO4+K2SO4+SO3+ H2O; 6.4. Йод: Cl2 + I2 ® ICl; 6.5. Кисень: H2O2 + ClO2 + NaOH ® NaClO2 + O2 + H2O; 6.6. Фосфор: P + ClO2 + H2O ® P2O5 + HCl; 6.7. Азот: KIO3 + KI + H2SO4 ® I2 + K2SO4 + H2O. 7. Виходячи з ряду напруг металів визначити, чи відбудеться хімічна реакція: 7.1. a) 2Al + 6HCl = 2AlCl3 + 3H2; b) Ag + NaNO3 = AgNO3 + Na; 7.2. a) Pb + CaCl2 = PbCl2 + Ca; b) Cu + 2HCl = CuCl2 + H2; 7.3. a) 2Ag + 2HNO3 = 2AgNO3 + H2; b) Sn + H2SO4 = SnSO4 + H2; 7.4. a) Fe + MgSO4 = FeSO4 + Mg; b) Ca + H2SO4 = CaSO4 + H2; 7.5. a) Fe + CuCl2 = FeCl2 + Cu; b) Hg + 2HCl = HgCl2 +H2; 7.6. a) 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2; b) Zn + 2NaCl = ZnCl2 + 2Na; 7.7. a) 3Mn + 2H3PO4 = Mn3(PO4)2 + 3H2; b) 2Na + CaCl2 = 2NaCl + Ca. 8. Який з наведених металів найбільш енергійний відновник: 8.1. Cu i Fe; 8.5. Fe i Pb; 8.2. Na i Zn; 8.6. Cr i Mn; 8.3. Cu i Al; 8.7. Na i Ca. 8.4. Ag i Mg; 9. Закінчити й урівняти рівняння реакцій та визначити, який елемент - відновник: 9.1. Na + H2SO4(конц) ®; 9.5. KH + H2O®; 9.2. Sn + HNO3(р) ®; 9.6. Ni + H2SO4(конц) ®; 9.3. NaH + Br2 ®; 9.7. Pb + NaOH ®; 9.4. K2Cr2O7 + Zn + HCl ®; 10. Визначити тип окисно-відновної реакції: 10.1. NO2 + H2O ® HNO3 + HNO2; 10.2. NO2 + KOH ® KNO3 + KNO2 + H2O; 10.3. NO2 + O3 ® N2O5 + O2; 10.4. NO2 + F2 + H2O ® HF + HNO3; 10.5. NO2 + H2O ® HNO3 + NO; 10.6. NO2 + H2SO3 ® H2SO3 + NO; 10.7. NO2 + HNO2 ® HNO3 + NO. 11. Властивості окисника чи відновника проявляє водень у рівнянні реакцій? 11.1. СaH2 + 2HCl ® СaCl2 + 2H2; 11.2. K2O + H2 ® KOH + KH; 11.3. Zn + 2HCl ® ZnCl2 + H2; 11.4. 3Fe + 4H2O ® Fe3O4 + 4H2; 11.5. 2Na + 2H2O ® 2NaOH + H2; 11.6. LiH + H2O ® LiOH + H2; 11.7. 2K + H2 ® 2KH. 12. Напишіть кисневі сполуки кислот елементу, зазначте найсильніші окисники: 12.1. Хлору; 12.5. Йоду; 12.2. Фосфору; 12.6. Брому; 12.3. Азоту; 12.7. Бору. 12.5. Сірки; КРИТЕРІЇ ОЦІНКИ ЗНАНЬ СТУДЕНТІВ НА ІСПИТАХ ТА ЗАЛІКАХ Згідно до “Положення про модульно-рейтингову систему навчання студентів та оцінювання їх знань” рейтинг з дисципліни Rдис визначається в балах відповідно до загальної кількості годин. Для допуску до іспиту або заліку студенту необхідно набрати мінімальну кількість балів для засвоєння матеріалу, що складає 50% (35 балів) від сумарної рейтингової оцінки змістових модулів - RОМ. Шкала оцінки визначається наступним чином:
5. ДОДАТКИ ДОДАТОК 1 Константи дисоціації деяких кислот та основ при 250 С
ДОДАТОК 2 Густина водних розчинів основ при 18 0С у г/см3
Густина водних розчинів кислот при 18 0С у г/см3
Таблиця розчинності солей та основ у воді
Примітка: Р - розчинні у воді; ВР - важкорозчинні (малорозчинні); Н - практично нерозчинні; риска означає, що речовина не існує або розкладається водою Продовження додатку 4
Добуток розчинності малорозчинних речовин
ДОДАТОК 7 Константи стійкості деяких комплексних іонів
ДОДАТОК 8 ТАБЛИЦЯ ЕЛЕКТРОНЕГАТИВНОСТІ ЗА ПОЛІНГОМ
Література: 1. Дрюк В. Г., Скляр С. И., Шульгин В. Ф. Краткий курс общей, неорганической и бионеорганической химии: Пособие для сельскохозяйственных вузов. – Нижневартовск: 1997. – 232 с. 2. Дрюк В. Г., Скляр С. И. Курс общей, неорганической и бионеорганической химии: Учебник для сельскохозяйственных вузов. – Симферополь: 1997. – 206 с. 3. Глинка Задачи и упражнения по общей химии: Учеб. Пособие для вузов. – 25-е изд., стер.- Л.:Химия, 1987.- 272 с. 4. Загальна хімія: Підручник для студентів вищих навчальних закладів/ О. І. Карнаухов, В. А. Копілевич, Д. О. Мельничук, М. С. Слободяник, С. І. Скляр, В. Є. Косматий, К. О. Чеботько. – К.: Фенікс, 2005. – 840 с. 5. Загальна та біонеорганічна хімія: Підручник для вищих навчальних закладів/О. І.Карнаухов, Д. О.Мельничук, К. О.Чеботько, В. А.Копілевич – К.: "Фенікс", 2001. – 577с. 6. Загальна та неорганічна хімія: Підручник для студентів вищих навчальних закладів/ В. А. Копілевич, О. І. Карнаухов, Д. О. Мельничук, М. С. Слободяник, С. І. Скляр, К. О. Чеботько. – К.: Фенікс, 2003. – 752 с. 7. Н. Б.Любимов. Вопросы и задачи по общей и неорганической химии. – М.: Высшая школа, 1990. – 351с. 8. Лабораторний практикум з неорганічної хімії/ В. Є.Косматий і ін. К.: Видавничий центр НАУ, 2002. – 158с. 9. Цитович И. К. Курс аналитической химии. М.: Высшая школа, 1985. – 400с. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Последнее обновление 27.11.11 21:10 |

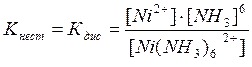 .
.