| МЕТОДИЧНІ ВКАЗІВКИ З курсу загальної, неорганічної і біонеорганічної хімії Для виконання завдань із самостійної роботи |
 |
 |
| Учебники методички лекции рабочие программы - Методички, методические указания |
| 27.11.11 19:43 |
|
Страница 2 из 5
1.3. Особливості номенклатури й класифікації неорганічних сполук та генетичний зв'язок між ними. Що треба знати: Ø Поняття про прості та складні речовини (атоми та молекули); Ø Правила складання молекулярних та побудови структурно-графічних формул речовин; Ø Формули найпоширеніших оксидів, кислот, гідроксидів та солей; Ø Систематичні назви хімічних сполук. Що треба вміти: Ø Складати молекулярні формули оксидів, кислот, гідроксидів та солей з урахуванням ступенів окиснення елементів; Ø Визначати тип оксидів та їх хімічні властивості, виходячи з положення елементів у періодичній системі; Ø Складати рівняння хімічних реакцій у молекулярному вигляді, які характеризують способи одержання та хімічні властивості оксидів, кислот, гідроксидів, солей; Ø За допомогою рівнянь реакцій доводити амфотерність сполук алюмінію, цинку, хрому, плюмбуму, їх оксидів та гідроксидів; Ø Складати структурно-графічні формули речовин. Контрольні завдання: 1. Записати формули вищих оксидів вказаних елементів і скласти рівняння реакцій, що доводять їх хімічний характер: Приклад: Калій, алюміній, селен. Відповідні їм вищі оксиди: К2О – основний оксид, Al2O3 – амфотерний оксид, SeO3 – кислотний оксид. К2О + Н2О ® 2KOH; Al2O3 + 6NaOH ® 2Na3AlO3 + 3H2O; SeO3 + K2O ® K2SeO4; Al2O3 + 6HCl ® 2AlCl3 + 3H2O. Хлор, купрум, берилій; Гідраргірум, фосфор, цинк; Манган, плюмбум, нітроген; Сульфур, алюміній, стронцій; Аргентум, барій, станум; Бром, стибій, кобальт; Хром, силіцій, кальцій. 2. Вивести формули оксидів, які відповідають наведеним сполукам, дати їм назву і вказати, до якого типу оксидів вони відносяться: Приклад: К2CO3: К2О – основний оксид, CO2 – кислотний оксид. MgCO3, H4P2O7, Ca(OH)2; 2.5. Ba(ClO4)2, H3PO4, Ni(OH)4; CaSO3, NaOH, HClO; 2.6. Na2SiO3, H2CO3, Fe(OH)3; Mg3(PO4)2, H2SO3, Mn(OH)4; 2.7. Zn(NO3)2, H3BO3, Cu(OH)2. CoSO4, H2SiO3, Al(OH)3; 3. Вказати хімічний характер оксидів. Скласти відповідні рівняння реакцій, що доводять їх властивості: Приклад: Na2О, PbO, Р2O5. 1) Na2О – основний оксид: Na2О + НCl ® NaCl + H2О; 2) PbO – амфотерний оксид: PbO + 2NaOH ® Na2PbO2 + H2O, PbO + 2HCl ® PbCl2 + H2O; 3) Р2O5 – кислотний оксид: Р2O5 + 3K2O ® 2K3PO4. 3.1. BeO, SiO2, Na2O; 3.5. SiO2, CrO3, MnO; 3.2. CaO, SO2, Al2O3; 3.6. Fe2O3, SO2, Na2O; 3.3. FeO, N2O3, Mn2O7; 3.7. MgO, Sb2O5, PbO. 3.4. NO2, CO, Al2O3; 4. Написати молекулярні й структурно-графічні формули: Приклад: гідроксид купрумy (ІІ) і хлорид алюмінію: Cu(OH)2 і AlCl3.
4.1. гідроксид стронцію та карбонат кальцію; 4.2. фосфатна кислота та сульфат заліза; 4.3. оксид хлору(VII) та нітрат цинку; 4.4. хлорид кальцію та фосфат алюмінію; 4.5. нітрит купруму(II) та вугільна кислота; 4.6. гідроксид стибію(III) та хлорна кислота; 4.7. гідрофосфат калію та цинкат натрію. 5. Скласти рівняння реакцій, що підтверджують амфотерність сполук: Приклад: PbO, Ве(ОН)2. PbO – амфотерний оксид: PbO + 2NaOH ® Na2PbO2 + H2O, PbO + H2SO4 ® PbSO4 + H2O; Ве(ОН)2 –амфотерний гідроксид: Ве(ОН)2+2КOH®К2ВеO2+2H2O, Ве(ОН)2+2HCl®ВеCl2+ H2O. 5.1. Cr2O3, Pb(OH)2; 5.5. Al2O3, Cr(OH) 3; 5.2. BeO, Al(OH)3; 5.6. PbO, Be(OH)2; 5.3. Sb2O3, Zn(OH)2; 5.7. SnO, Sb(OH)3. 5.4. ZnO, Sn(OH)2; 6. Написати рівняння реакцій одержання сполук п'ятьма способами: Приклад: карбонат кальцію: CaCO3. 1) Ca(OH)2 + H2CO3 ® CaCO3 + 2H2O, 4)Ca(OH)2 + CO2 ® CaCO3 + H2O, 2) CaO + CO2 ® CaCO3, 5)CaO + H2CO3 ® CaCO3 + H2O, 3) Ca(HCO3)2 + Ca(OH)2 ® CaCO3 + 2H2O. 6.1. фосфат кальцію; 6.5. нітрат цинку; 6.2. сульфат барію; 6.6. сульфід купруму(II); 6.3. хлорид цинку; 6.7. гідрофосфат магнію. 6.4. карбонат амонію; 7. Здійснити такі перетворення: Приклад: Na ® Na2O ® Na2PbO2 ®NaCl ® AgCl. 1) NaCO3 2) Na2O + PbO ® Na2PbO2; 4) NaCl + AgNO3 ® AgCl¯ + NaNO3.
Na2PbO2 7.2. N2 ® NH3 ® (NH4)2SO4 ® NH4HSO4 7.3. BaO ® BaCl2 ® Ba3(PO4)2 ® Ba(H2PO4)2 ® Ba(NO3)2 7.4. Zn ® ZnO ® ZnSO4 ® Zn(OH)2 ® Na2ZnO2 ® ZnSO4 7.5. CO ® CO2 ® CaCO3 ® CaO ® Ca(OH)2 ® Ca3(PO4)2 ® Ca(H2PO4)2 7.6. S ® SO2 ® SO3 ® H2SO4 ® NH4HSO4 ® (NH4)2SO4 ® NH4OH ® NH3 7.7. Sb2O3 ® Sb(NO3)2 ® Sb(OH)3 ® K3SbO3 ® SbCl3 8. Закінчити рівняння реакцій: 8.1. Ba(OH)2 + N2O5 ® 8.5. Al2O3 + KOH ® CaO + PbO ® HClO4 + CaO ® SO2 + Co2O3 ® Mn2O7 + NaOH ® 8.2. Ca(OH)2 + SO3 ® 8.6. Ca(OH)2 + NO2 ® ZnO + Na2O ® (NH4)2SO4 + H2SO4 ® Mg(NO3)2 + KOH ® Fe(OH)3 + HNO2 ® 8.3. H2SO4 + NiO ® 8.7. Al(OH)3 + NaOH® CO2 + SrO ® Zn(NO3)2 + K3PO4 ® Al(OH)3 + K2O ® BaO + B2O3 ® 8.4. Na2SiO3 + HCl ® CuSO4 + KOH ® Na3PO4 + H3PO4 9. Які сполуки взаємодіють попарно (написати рівняння реакцій)? Приклад: Al2O3, CO2, Na2O, H2O. 1) Al2O3 + 3CO2 ® Al2(CO3)3; 4) CO2 + Na2O ® Na2CO3; 2) Al2O3 + 3Na2O ® 2Na3AlO3; 5) CO2 + H2O ® H2CO3; 3) 9.1. N2O5, BaO, H2O, ZnO; 9.5. Al2O3, CO2, FeO, BaO; 9.2. SiO2, BeO, CuO, P2O5; 9.6. CoO, N2O3, Na2O, SrO; 9.3. SO2, CO, Na2O, SnO; 9.7. Cr2O3, CrO3, MgO, SO3. 9.4. PbO, NO2, MgO, Cl2O7; 10. Які оксиди взаємодіють із водою (написати рівняння реакцій): Приклад: SiO2, CrO3, CO2, K2O. 1) CrO3 + H2O ® H2CrO4; 3) K2O + H2O ® 2KOH. 2) CO2 + H2O ® H2CO3; 10.1. MgO, CuO, Na2O, CO2; 10.5. Co2O3, Sb2O3, N2O3, P2O5; 10.2. BaO, PbO, SO2, SiO2; 10.6. MnO2, P2O5, Mn2O7, SrO; 10.3. CaO, NiO, Fe2O3, ZnO; 10.7. Sb2O5, V2O5, N2O5, MoO3. 10.4. Al2O3, Li2O, Cl2O7 , Fe2O3; 11. Визначити валентність і ступінь окиснення елементів у сполуках: 11.1. Cu2O, Co(OH)3, NH4NO3; 11.5. Co2O3, HClO, CuS; 11.2. HPO3, Al2O3, NaHSO4; 11.6. NaOH, NH3, Na2SO3; 11.3. FeO, KOH, Ca3(PO4)2; 11.7. K2O2, P2O3, KH2PO4. 11.4. (NH4)2CO3, HNO2, Mg(HCO3)2; 12. Написати всі можливі реакції між сполуками: Приклад: гідроксид магнію і сульфідна кислота: 1) Mg(OH)2 + H2S ® MgS + 2H2O; 2) Mg(OH)2+ 2H2S ® Mg(HS)2 + 2H2O; 3) 2Mg(OH)2+ H2S ® (MgOH)2S + 2H2O. 12.1. гідроксид калію і сульфатна кислота (дві реакції); 12.2. гідроксид алюмінію й гідроксид натрію (три реакції); 12.3. гідроксид кальцію і сульфітна кислота (три реакції); 12.4. гідроксид міді й нітратна кислота (дві реакції); 12.5. гідроксид цинку і фосфатна кислота (чотири реакції); 12.6. гідроксид натрію й гідроксид свинцю (дві реакції); 12.7. гідроксид алюмінію й ацетатна кислота (три реакції). 2. Основні закони хімічних перетворень. 2.1. Хімічна кінетика і рівновага. Методичні поради щодо виконання самостійної роботи. Що треба знати: Ø Закон діючих мас та його математичний вираз; Ø Визначення понять "гомогенні", "гетерогенні" системи; Ø Термохімічні ефекти реакцій, екзотермічні та ендотермічні реакції; Ø Фактори, що впливають на швидкість хімічної реакції. Правило Вант-Гоффа; Ø Природа хімічної рівноваги та принцип Ле-Шательє; Ø Фактори, що вливають на зміщення стану хімічної рівноваги в системі. Що треба вміти: Ø Записувати формулу виразу швидкості хімічної реакції; Ø Розраховувати зміну швидкості хімічної реакції залежно від зміни концентрації реагуючих речовин та температури; Ø Записувати вираз константи хімічної рівноваги для даної оборотної реакції та визначати напрямок зміщення рівноваги залежно від зміни концентрації реагентів, температури та тиску в системі. Про що треба мати уявлення: Ø Поняття про активну молекулу та енергію активації; Ø Природу процесу каталізу; Ø Фазу, компонент, систему. Необхідний для засвоєння матеріал із даної теми в літературі [1-3, 4-5, 6-8]. Осибливу увагу необхідно звернути на закон діючих мас і на його основі - стан хімічної рівноваги в оборотних процесах, де швидкість прямої та зворотної реакцій рівні. VПрям. = VЗворотн. Найважливішою характеристикою стану рівноваги є константа рівноваги К. Константа рівноваги вказує у скільки разів швидкість прямої реакції більша за швидкість зворотної при даних температурі й концентраціях. Оскільки загальне число кількості твердої речовини не впливає на швидкість реакції, то і концентрація твердих речовин не входить у константу рівноваги. Наприклад, 1) 2СО(Г) + О2(Г) = 2СО2(Г)
2) C(тв) + О2(Г) = СО2(Г)
Приклад рішення завдання: Як зміниться швидкість хімічної реакції 4HCl + O2 = 2Cl2 + 2H2O, що протікає в газовій фазі, якщо збільшити: 1) концентрацію кисню в три рази; 2) концентрацію хлороводню у два рази; 3) тиск у два рази? Розв'язок: 1) Швидкість прямої реакції дорівнює: V = K [HCl]4 · [O2] = K · A4 · B, Де [HCl] = A, [O2] = B. Швидкість прямої реакції при збільшенні концентрації кисню дорівнює: V1 = K [HCl]4 · 3[O2] = K · A4 · 3B = 3K A4 B. Швидкість реакції збільшиться в:
Отже, при збільшенні концентрації кисню в три рази швидкість реакції збільшиться в три рази. 2) V2 = K · (2A)4 · B = 16K A4 B
Швидкість реакції при збільшенні концентрації HCl в 2 рази, збільшиться в 16 разів. 3) V3 = K · (2A)4 · 2B = 32K A4 B
При збільшенні тиску в 2 рази швидкість реакції збільшиться в 32 рази. Контрольні завдання: 1. Згідно закону діючих мас написати вираз для швидкості реакції: 1.1. 3H2(г) + N2(г) « 2NH3(г); 1.5. 2NO(г)+ O2(г) « NO2(г); 1.2. 2Fe(Т) + 3Сl2(г) ® 2FeCl3; 1.6. H2(г) + S « H2S(г); 1.3. 2SO2(г) + O2(г) « 2SO3(г); 1.7. H2(г) + I2(г) « 2HI(г); 1.4. H2SO4 + 2KOH ® K2SO4 + 2H2O; 2. Як зміниться швидкість реакції утворення амоніаку з азоту й водню, якщо: 2.1. збільшити концентрацію вихідних речовин удвічі; 2.2. збільшити концентрацію азоту у два рази; 2.3. зменшити концентрацію азоту у два рази; 2.4. у два рази збільшити тиск системи; 2.5. тиск у системі збільшити у 5 разів; 2.6. у два рази зменшити тиск системи; 2.7. збільшити концентрацію водню у два рази. 3. Як зміниться швидкість реакції, якщо температурний коефіцієнт γ дорівнює 3, при підвищенні температури: Приклад: з 40 до 80 оС; Швидкість реакції при підвищенні температури з 40 до 80 оС зміниться у 81 раз. 3.1. з 80 до 100 оС; 3.5. з 100 до 120 оС; 3.2. з 40 до 60 оС; 3.6. з 80 до 160 оС; 3.3. з 20 до 80 оС; 3.7. з 60 до 100 оС. 3.4. з 30 до 50 оС; 4. Визначити константу рівноваги реакції: Приклад: 3Н2 + N2 « 2NH3, Якщо [NH3] = 0,2 моль/л; [N2] = 0,5 моль/л; [H2] = 0,10 моль/л.
4.1. 2SO2 + O2 « 2SO3, Якщо [SO2] = 0,04 моль/л; [O2] = 0,06 моль/л; [SO3] = 0,02 моль/л. 4.2. 3H2 + N2 « 2NH3, Якщо [NH3] = 0,4 моль/л; [N2] = 0,3 моль/л; [H2] = 0,10 моль/л. 4.3. СО + Cl2 = COCl2 (фосген), Якщо [СO] = 0,28 моль/л; [Cl2] = 0,09 моль/л; Рівноважна [СO] = 0,20 моль/л. 4.4. С(Т) + О2(г) « СО2(г), Якщо [O2] = 0,01 моль/л; [СO2] = 0,04 моль/л. 4.5. 2NO+ O2 « 2NO2, Якщо [NO] = 0,02 моль/л; [O2] = 0,01 моль/л; [NO2] = 0,03 моль/л. 4.6. N2 + O2 « 2NO, Якщо [N2] = 0,1 моль/л; [O2] = 0,05 моль/л; [NO] = 0,02 моль/л. 4.7. S(Т) + O2(г) = SО2(г), Якщо [O2] = 0,02 моль/л; [SО2] = 0,04 моль/л. 5. Якою буде концентрація речовини В після реакції А2 + В2 = 2АВ, якщо концентрація речовини А зменшилась до 0,5 моль/л. Початкова концентрація речовин дорівнює: Приклад: [А] = 0,9 моль/л, [В] = 0,8 моль/л; За реакцією А2 + В2 = 2АВ 1 моль речовини А Реагує з 1 моль речовини В, тобто зміна "С" речовини А і В буде одноковою. DС(А) = 0,9 – 0,5 = 0,4 моль/л; DС(В) = 0,8– 0,5 = 0,3 моль/л. 5.1. [А] = 0,8 моль/л, [В] = 1,0 моль/л; 5.2. [А] = 0,14 моль/л, [В] = 0,/8 моль/л; 5.3. [А] = 1,0 моль/л, [В] = 0,6 моль/л; 5.4. [А] = 1,2 моль/л, [В] = 0,8 моль/л; 5.5. [А] = 1,0 моль/л, [В] = 0,8 моль/л; 5.6. [А] = 0,8 моль/л, [В] = 0,8 моль/л; 5.7. [А] = 0,9 моль/л, [В] = 0,6 моль/л; 6. Як зміниться швидкість реакції 2Fe(Т) + 3Сl2(г) ® 2FeCl3(Т), якщо: Приклад: тиск у системі зменшиться у 3 рази. Підвищення тиску зміщує рівновагу системи в бік утворення менших об'ємів, а зменшення – в бік утворення більших об'ємів. Якщо тиск у системі зменшиться у 3 рази, то швидкість зворотньої реакції збільшиться в 3 рази. 6.1. тиск у системі збільшити в 5 разів; 6.2. тиск у системі зменшити в 2 рази; 6.3. концентрацію хлору зменшити в 3 рази; 6.4. температуру в системі підвищити з 20 до 60 оС, якщо температурний коефіцієнт γ = 2; 6.5. температуру в системі змінити з 40 до 100 оС, температурний коефіцієнт γ = 3; 6.6. концентрацію феруму збільшити в 2 рази; 6.7. тиск у системі збільшити в 2 рази; 7. Як зміниться стан рівноваги в реакції при збільшенні тиску, зменшенні концентрації одного з компонентів: 7.1. H2(г) + I2(г) « 2HI(г) + Q; 7.2. 2NO2(г) « 2NO(г)+ O2(г) - Q; 7.3. 3H2(г) + N2(г) « 2NH3(г) + Q; 7.4. H2(г) + S(Т) « H2S(г) + Q; 7.5. Сl2(г) + Н2(г) ® 2НCl(г) + Q; 7.6. 2NО(г) + Cl2(г) = 2NOCl(г) + Q; 7.7. N2O4(г) « 2NO2(г) - Q. 8. Як зміниться рівновага наведеної реакції при зміні тиску: 8.1. Сl2 + Н2 ® 2НCl; 8.5. 2NО + Cl2 = 2NOCl; 8.2. N2 + O2 « 2NO; 8.6. NH3 + Н2О = NH4ОН; 8.3. 2SO2 + O2 « 2SO3; 8.7. 3H2 + N2 « 2NH3. 8.4. 2NO2 + O2 + 2Н2О « 4НNO3 9. Як зміниться швидкість прямої реакції, якщо каталізатор: 9.1. впливає на склад продуктів реакції; 9.2. зміщує стан рівноваги вліво; 9.3. не впливає на склад продуктів реакції; 9.4. не бере участі в реакції; 9.5. не зміщує стан рівноваги; 9.6. не впливає на константу швидкості; 9.7. впливає на константу швидкості. 10. В яку сторону буде зміщена рівновага при підвищенні температури в системі: Приклад: СО + О2 ® СО2 – Q. Під час підвищення температури рівноважної системи рівновага зміщується в бік ендотермічної реакції, під час зниження – в бік екзотермічної. В нашому випадку, при підвищенні температури, рівновага зміщується в бік прямої (ендотермічної) реакції. 10.1. 3H2(Г) + N2(г) « 2NH3(г) + 92,4 кДж; 10.2. 2СО2(г) « 2СО(г) + O2(г) + 566 кДж; 10.3. НСl(Г) + O2(г) « Сl2(Г) + 2Н2О - 202,4 кДж; 10.4. СаО(Т) + СО2(г) « СаСО3(Т) + Q; 10.5. 2КСlО3(т) « 2КСl(т) + 3O2(г) + Q; 10.6. 2Н2(г) + O2(г) « 2Н2О(Г) + Q; 10.7. N2(г) + O2(г) « 2NO - 108,4 кДж. 11. У скільки разів зросте швидкість взаємодії водню з бромом у газовій фазі, якщо: 11.1. [Н2] збільшити в 2 рази, [Вr2] - в 3 рази; 11.2. [Н2] збільшити в 3 рази, [Вr2] - в 2 рази; 11.3. [Н2] збільшити в 1,5 рази, [Вr2] - в 1,5 раза; 11.4. [Н2] збільшити в 3 рази, [Вr2] - в 1,5 раза; 11.5. [Н2] збільшити в 2 рази, [Вr2] - в 4 рази; 11.6. [Н2] збільшити в 4 рази, [Вr2] - в 2 рази; 11.7. [Н2] збільшити в 3 рази, [Вr2] - в 3 рази. 12. У скільки разів слід збільшити концентрацію водню в реакції 3H2(Г) + N2(г) « 2NH3(г), щоб її швидкість зросла: 12.1. у 125 разів; 12.5. у 54 рази; 12.2. у 27 разів; 12.6. у 216 разів; 12.3. у 8 разів; 12.7. у 27 разів; 12.7. у 64 рази 2.2. Поняття про розчини (газоподібні, тверді, рідкі). Методичні поради, щодо виконання самостійної роботи. Загальний об'єм необхідного матеріалу міститься в лабораторному практикумі [4,5], де вказані вимоги: що треба знати, що треба вміти, про що треба мати уявлення, і в основній літературі [1,2]. Газовий розчин - фізична суміш, в якій кожний компонент проявляє індивідуальні фізичні та хімічні властивості. Приклад, повітря, яке містить розчинені один в одному азот (78% по об'єму), кисень (21%), інертні гази (~ 1%), диоксид вуглецю, пари води та деякі домішки. При звичайному тиску гази необмежено розчиняються один в одному (змішуються в будь-яких співвідношеннях). Твердий розчин - являє собою змішаний кристал. Кристалічну гратку твердого розчину утворюють частинки двох або більше речовин, розміщених одна відносно іншої невпорядковано. В залежності від способу розміщення частинок розрізняють тверді розчини заміщення і тверді розчини вкорінення. Необхідною умовою утворення твердих розчинів є також близькість хімічних властивостей речовин (однаковий тип хімічного зв'язку). Наприклад, безперервний ряд твердих розчинів заміщення в залежності від типу хімічного зв'язку: 1) Se - Te, Si - Ge - ковалентний; 2) KCl - KBr, K2SO4 - K2BeF4 - іонний; 3) Ag - Au, Au - Pt - металічний; 4) Br2 - I2 - молекулярний. Тверді розчини вкорінення, наприклад, утворюються у випадку кристалізації заліза та вуглецю, або у випадку адсорбції деякими металами водню. Рідкий розчин - гомогенна система, в якій частинки розчиненої речовини розупорядковані між частинками розчинника. Для водних розчинів - утворюються комплекси-гідрати, для неводних - комплекси-гідрати. Для засвоєння теми "Електролітична дисоціація" треба обов'язково знати кількісні характеристики: ступінь і константу електролітичної дисоціації, способи вираження концентрації розчинів (процентна, молярна, нормальна, титр). Для засвоєння теми "Гідроліз солей" обов'язково треба знати поняття: іонний добуток води, водневий показник рН, ступінь і константа гідролізу. Серед понять, про які потрібно мати уявлення такі: активність іона, коефіцієнт активності, добуток розчинності. Активність іона Аі - концентрація відповідно якій він проявляє себе в хімічній реакції: Аі = Fі ·[I] Fі - коефіцієнт активності; [I] - концентрація іона. Величина коефіцієнта активності Fі залежить від величини іонної сили m, яка визначається в залежності від концентрації й заряду іона: M = 1/2 (с1z12 + с2z22 + ... + сnzn2). Добуток розчинності - кількісна характеристика для малорозчинних електролітів. Сильний малорозчинний електроліт складає тверду фазу і в момент динамічної рівноваги вираз добутку розчинності такий: ДРАВ = [An+] · [Bn-] = const. Ступінь гідролізу H- кількісна величина реакції гідролізу солі, визначає відношення числа молекул солі, яка гідролізує до загального числа молекул, або через молярну концентрацію:
H залежить від 1) хімічної природи іонів; 2) температури; 3) концентрації. Константа гідролізу Кгідр. визначається в залежності від іонного складу солі. В разі гідролізу солі за катіоном (сіль утворена слабкою основою та сильною кислотою)
Кв - іонний добуток води; КОсн - константа дисоціації основи, яка утворюється в результаті гідролізу. В разі гідролізу солі за аніоном (сіль утворена сильною основою та слабкою кислотою):
ККисл. - константа дисоціації слабкої кислоти, яка утворюється в результаті гідролізу. В разі гідролізу солі за катіоном і аніоном (сіль утворена слабкою основою та слабкою кислотою):
|
| Последнее обновление 27.11.11 21:10 |

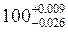
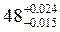
 ;
;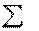 .
.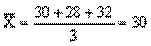 рази
рази разів
разів рази
рази
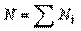 , у відсотках
, у відсотках  %
%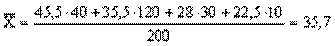 ;
;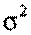 ;
;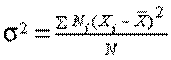 .
.


