| МЕТОДИЧНІ ВКАЗІВКИ З курсу загальної, неорганічної і біонеорганічної хімії Для виконання завдань із самостійної роботи |
 |
 |
| Учебники методички лекции рабочие программы - Методички, методические указания | |||||||||||||||||||||||||||||||||||||||||||||||
| 27.11.11 19:43 | |||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 3 из 5
2.3. Особливості електролітичної дисоціації кислот, основ і солей та реакції у розчинах електролітів.
Контрольні завдання: 1. Які сполуки відносяться до сильних і слабких електролітів? Для слабких електролітів написати вираз константи дисоціації: Приклад: НВО2 ↔ Н+ + ВО2-; 1.1. CaCl2, H2SO3, (NH4)3PO4; 1.5. Na2S, H2S, Ca(OH)2; 1.2. H2BeO2, Ca(OH)2, HNO3; 1.6. CuSO4, Ni(OH)2, HCN; 1.3. HClO, (NH4)2CO3, NH4OH; 1.7. H2CO3, H2SiO3, NaOH. 1.4. Ca(ClO2)2, H3PO4, H2SO4; 2. Як дисоціюють сполуки електролітів? Приклад: HClO ↔ H+ + ClO-. 2.1. Na3PO4, H2CrO4, Co(OH)3; 2.5. 3HCl, Al(OH)3, ZnSO4; 2.2. Ca(OH)2, Ca(NO3)2, NaHSO4; 2.6. Fe(NO2)2, HCN, NaOH; 2.3. H3PO4, Co(OH)3, 2Al2(SO4)3; 2.7. AgNO3, Ba(OH)3, Na2S. 2.4. MgOHCl, 2Ag3PO4, NH4H2PO4; 3. Визначити скільки Г речовини міститься в розчині і розрахувати титр розчину (густиною знехтувати). Приклад: 0,2 н НCl.
3.1. 2н HNO3; 3.5. 0,2М H2SO4; 3.2. 6% NaOH; 3.6. 0,5н НCl; 3.3. 0,1н СН3СООН; 3.7. 0,5М KMnO4. 3.4. 10% NH4ОН; 4. Яких частинок розчиненої речовини найбільше у водному розчині: Приклад: HClO4 (іонів Н+,молекул HClO4, іонів
4.1. Н2S (молекул Н2S, іонів Н+, іонів S2-, іонів НS-); 4.2. H2SO4(р-н) (H2SO4, Н+, SO42-, НSO4-); 4.3. H3PO4 (Н+, ОН-, PO43-, H2PO4-, HPO42-); 4.4. H2SO3 (Н+, HSO3-, H2SO3, SO32-); 4.5. Н2СО3 (Н+, HСO3-, Н2СО3, СO32-, ОН-); 4.6. HNO3 (Н+, NO3-, HNO3, ОН-); 4.7. H4P2O7 (Н+, ОН-, H3P2O7-, H2P2O72-, HP2O73-). 5. Вкажіть пару електролітів, реакція між якими у водному розчині неможлива (довести рівняннями реакцій): Приклад: NaOH та HNO3, NaCl та Ba(NO3)2; 1)
2)
Реакція неможлива. 5.1. Na2S та HCl, NaBr та KOH; 5.2 K2СО3 та H2SO4, NaCl та HNO3; 5.3. Fe(NO3)3 та NaOH, Ca(OH)2 та HCl; 5.4. MgSO4 та (NH4)3PO4, NaClO4 та HNO3; 5.5. CuS та HNO3, CuSO4 та HBr; 5.6. K2SiО3 та HCl, (NH4)2SO4 та HI; 5.7. Al(NO3)3 та Na2СО3, AlCl3 та HNO3. 6. Написати молекулярні та іонні рівняння реакцій, які відбуваються між вказаними сполуками: Приклад: гідроксид натрію, гідроксид алюмінію, хлоридна кислота. 1)
2)
3)
6.1. Гідроксид купруму(ІІ), хлороводнева кислота, гідроксид кальцію, нітрат срібла, сульфат натрію; 6.2. Ортофосфатна кислота, гідроксид натрію, сульфат купруму(ІІ), хлорид кальцію, гідроксид амонію; 6.3. Фосфат натрію, карбонат кальцію, сульфатна кислота, нітрат барію, гідроксид амонію; 6.4. Силікат натрію, хлороводнева кислота, фосфат амонію, гідроксид калію; 6.5. Карбонат натрію, хлорид барію, ацетатна кислота, гідроксид феруму(ІІІ), нітратна кислота; 6.6. Сульфат амонію, ацетат свинцю, гідроксид натрію, сульфатна кислота, нітрат срібла; 6.7. Хромат калію, хлорид барію, гідроксид натрію, сульфатна кислота, нітрат свинцю. 7. Вибрати слабкий електроліт і записати для нього константу дисоціації по ступеням: Приклад: фосфат кальцію, нітрат амонію, нітритна кислота. Са3(РО4)3 – сіль, нерозчинна у воді, слабкий електроліт, для неї записують вираз добутку розчинності ДР; NH4NO3 - сіль, розчинна у воді, сильний електроліт; HNO2 – кислота, слабкий електроліт: 7.1. Нітратна кислота, гідроксид амонію, карбонат кальцію; 7.2. Хлорна кислота, гідроксид натрію, гідроксид цинку; 7.3. Сульфат барію, гідроксид стронцію, карбонатна кислота; 7.4. Гідроксид калію, сульфідна кислота, хлорид амонію; 7.5. Кремнієва кислота, гідроксид барію, сульфіт натрію; 7.6. Фосфатна кислота, карбонат амонію, гідроксид кальцію; 7.7. Фосфат амонію, гідроксид хрому(ІІІ), ацетат натрію. 8. Скласти по три рівняння в молекулярній формі, які відповідають таким рівнянням у скороченій іонній формі: Приклад: 1) 2) 3) 8.1. OH - + H+ = H2O; 8.5. Al(OH)3 + 3H+ = Al3+ + H2O; 8.2. Co2+ + 2OH- = Co(OH)2¯; 8.6. Ni2++ S2- = NiS¯; 8.3. 3Ca2+ + 2PO43- = Ca3(PO4)2¯; 8.7. NH4+ + OH - = NH3 + H2O. 8.4. Pb(OH)2 + 2OH- = PbO22- + 3H2O; 9. Написати молекулярні та іонні рівняння не менш як трьох реакцій одержання таких сполук: 9.1. Сульфату свинцю(ІІ), оксиду вуглецю(IV), ортофосфатної кислоти; 9.2. Гідроксиду міді(І), ацетатна кислоти, фосфату магнію; 9.3. Карбонату кальцію, сульфідної кислоти, гідроксиду хрому(ІІІ); 9.4. Нітритної кислоти, хромату барію, гідроксиду амонію; 9.5. Сульфітної кислоти, алюмінату натрію, карбонату магнію; 9.6. Хлориду срібла, перхлорату кальцію, нітрату феруму(ІІІ); 9.7. Ацетату алюмінію, йодиду свинцю, борату натрію. 10. Визначити концентрацію розчину (у %) при розчиненні: Приклад: 5 Г хлориду натрію в 95 Г води.
10.1 50г цукру в 200г води; 10.2 30г цукру в 240г 10%-ного його розчину; 10.3. При змішуванні 120г 10%-ного і 40г 90%-ного розчинів ацетатної кислоти. 10.4. 100г ангідриду сірчаної кислоти в 150г води; 10.5. 40г мідного купоросу в 160г розчину; 10.6. При змішуванні 200г 2%-ного і 300г 6%-ного розчинів мідного купоросу; 10.7. 50г ангідриду сірчаної кислоти в 300г води. 11. Вказати пару електролітів реакції між якими можливі (написати рівняння реакцій): 11.1 Na2S і HCl, NaOH і HNO3, KCl i NaNO3; 11.2. K2CO3 i H2SO4, CH3COOK i AgNO3, MgSO4 i HNO3; 11.3. Fe(NO3)2 i K2SO4, Ca(OH)2 i H2SO4, KOH i H3PO4; 11.4. Sr(OH)2 i H2SO4, NaOH i HNO3, H4P2O7 i KCl; 11.5. K2S і Na2SO3, ZnCl2 i H2SO4, NH4Cl i AgNO3; 11.6. Co(OH)3 i HNO3, HClO4 i MnSO4, LiOH i NaCl; 11.7. Na2SiO3 i Na2SO4, H3PO4 i Ca(OH)2, KCN i Na2SO4. 12. Яка загальна концентрація йонів (моль/л) після дисоціації 1 моль сполуки (вказати концентрацію поступінчасто): Приклад: Co(OH)3.
1моль 1моль 3 моль Після дисоціації загальна концентрація йонів 4 моль/л. 12.1. Н2CO3; 12.2. Cu(NO3)2; 12.3. FeCl3; 12.4. Na3PO4; 12.5. Na2H2P2O7; 12.6. CaOHCl; 12.7. Co(HSO4)3. 2.4. Гідроліз солей. Що треба знати: Ø Що називається іонним добутком води? Чому він дорівнює? Ø Що таке водневий показник? Ø Якими величинами рН характеризується нейтральне, кисле та лужне середовище? Ø Чому дорівнює величина водневого показника чистої води при 22 оС? Ø Який процес називається гідролізом? Ø Що таке ступінь та константа гідролізу? Що треба вміти: Ø Розраховувати рН і рОН розчинів за концентрацією іонів водню або іонів гідроксилу; Ø Визначати середовище розчину за допомогою індикаторів; Ø Складати молекулярні та іонні рівняння гідролізу; Про що треба мати уявлення: Ø Буферні розчини в хімії та біології. Контрольні завдання: 1. Які йони не можуть одночасно перебувати в помітних кількостях у водному розчині? Приклад: 1) 2) 1.1. Na+ i SO42-, Ag+ i NO3-, Ba2+ i NO2-; 1.2. K+ i PO43-, Ca2+ i Cl-, Li+ i NO3-; 1.3. K+ i OH-, H+ i CO32-, Sr2+ i HSO3-; 1.4. Zn2+ i SO42-, Na+ i HPO42-, Fe2+ i І-; 1.5. H+ i S2-, K+ i NO3-, Cu2+ i Br-; 1.6. Ca2+ i OH-, Pb2+ i Cl-, H+ i ClO4-; 1.7. Li+ i HCO3-, Al3+ i OH-, Ni2+ i CO32-. 2. Які йони можуть існувати у помітних кількостях у лужному середовищі? Приклад: Йони 2.1. AlOH2+, H3O, K+, SO42-; 2.5. PO43-, OH-, Na+, FeOH2+; 2.2. HSO4-, Ni2+, Al3+, S2-; 2.6. HSO3-, K+, BiOH+, SO32-; 2.3. Na+, ZnOH+, Mg2+, Cl-; 2.7. Ca2+, Na+, H+, CO32-. 2.4. BaOH+, Ca2+, ClO-, HPO42-; 3. Вкажіть колір індикатора у розчині: Приклад: нітрат цинку.
4. Визначити та порівняти реакцію середовища водних розчинів солей (написати відповідні реакції, див. приклад №3): 4.1. Ацетату натрію й сульфату натрію; 4.2. Сульфіду амонію й сульфату амонію; 4.3. Хлориду міді й хлориду барію; 4.4. Сульфіту калію й сульфіту амонію; 4.5. Карбонату літію й карбонату алюмінію; 4.6. Фосфату натрію й нітрату магнію; 4.7. Нітриту барію й нітрату барію. 5. Яких йонів найменше у водному розчині: Приклад: Фосфату калію ( 5.1 Карбонату калію (K+, CO32-, H+, OH-, HCO3-); 5.2. Сульфату міді (Cu2+, SO42-, H+, OH-, CuOH+); 5.3. Хлориду цинку (Zn2+, Cl-, H+, OH-, ZnOH+); 5.4.Сульфату феруму(ІІІ)(Fe3+, Fe(OH)2+, FeOH2+, H+, OH-, SO42-); 5.5. Хлориду амонію (NH4+, H+, OH-, Cl-); 5.6. Силікату натрію (Na+, H+, OH-, SiO32-, HSiO3-); 5.7. Нітрату магнію (Mg2+, H+, OH-, MgOH+, NO3-). 6. Гідроліз якої солі описується рівнянням (написати приклади рівнянь в молекулярному і повному йонному вигляді): Приклад: 6.1. Al3+ + НОН « AlOH2+ + H+; 6.2. S2- + НОН « HS - + OH-; 6.3. Mg2+ + НОН « MgOH+ + H+; 6.4. NH4+ + НОН « NH4OH + H+; 6.5. SO32- + НОН « HSO3- + OH-; 6.6. HPO42- + НОН « H2PO4- + OH-; 6.7. Cr3+ + CH3COO - + НОН « CrOH2+ +CH3COOH. 7. Визначити рН і рОН розчину: Приклад 1: Концентрація Н+ у розчині 4,3·10-4. Визначити рН і рОН розчину. Рішення: рН = -lg[Н+] = - lg4,3·10-4 = -( lg4,3 + lg10-4) = -(0,63 - 4) = 3,37; рОН = 14 - рН = 14 – 3,37 = 10,63. Відповідь: рН = 3,37, рОН = 10,63. Приклад 2: концентрація Н+ у розчині 4·10-6. Визначити рН і рОН розчину. Рішення: рН = -lg[Н+] = - lg4·10-6 = -( lg4 + lg10-6) = -(0,60 - 6) = 5,4 рОН = 14 - рН = 14 – 5,4 = 8,6. Відповідь: рН = 5,4, рОН = 8,6. 7.1. якщо концентрація Н+ у розчині 2·10-4; 7.2. якщо концентрація Н+ у розчині 4,5·10-11; 7.3. якщо концентрація ОН - в розчині 5·10-2; 7.4. якщо концентрація Н+ у розчині 3,2·10-5; 7.5. якщо концентрація ОН - в розчині 4,6·10-3; 7.6. якщо концентрація Н+ у розчині 3,8·10-10; 7.7. якщо концентрація ОН - в розчині 2,1·10-1. 8. Чому дорівнює концентрація Н+ і ОН- в розчині, рН якого дорівнює: Приклад: Визначити концентрацію Н+ та ОН - у розчині, якщо рН = 4,5. Рішення: lg[Н+] = - рН = -4,5 = -(5 – 0,5) = -5 + 0,5 [Н+] » 10-5·3,2; [ОН-] = 10-14/ [Н+] = 10-14 / 3,2·10-5 = 3,12·10-8. Відповідь: [Н+] » 3,2·10-5, [ОН-] = 3,12·10-8. 8.1. 4,87; 8.5. 10,0; 8.2. 3,5; 8.6. 0,5; 8.3. 9,4; 8.7. 4,0. 8.4. 3,0; 9. Чому дорівнює рН розчину, якщо: 9.1. [H+] = 10-3 г·іон/л; 9.5. [H+] = 10-4 г·іон/л; 9.2. [ОH-] = 10-5 г·іон/л; 9.6. [ОH-] = 10-11 г·іон/л; 9.3. [H+] = 10-2 г·іон/л; 9.7. [H+] = 10-1 г·іон/л. 9.4. [ОH-] = 10-5 г·іон/л; 10. Визначити константу гідролізу КГідр солі при 18 оС: Приклад: Сіль NH4ClO4 утворена слабкою основою NH4ОН і сильною кислотою НСlO4 Рішення: ( Відповідь: КГідр = 4,23·10-10. 10.1. NH4NO3; 10.5. CH3COOK; 10.2. CH3COONa; 10.6. NH4NO2; 10.3. CH3COONH4; 10.7. NH4І. 10.4. NaF; 11. Визначити [H+] і ступінь гідролізу: Приклад: Обчислити [H+] і ступінь гідролізу 0,1М розчину NH4NO3. Рішення: ( Ступінь гідролізу: Відповідь: [H+] =6,5·10-6 г·іон/л; h = 6,5·10-5 або 6,5·10-3%. 11.1. 0,01М NH4Cl; 11.5. 1н KClO; 11.2. 0,001М NaCN; 11.6. 0,01н KClO; 11.3. 0,1н NH4Br; 11.7. 0,001н KClO. 11.4. 0,1М CH3COONH4; 12. Визначити Кгідр: Приклад: Визначити КГідр HCOONa i КГідрHCOONH4. Рішення: HCOONa + HOH « HCOOH + NaOH HCOONH4 + HOH « HCOOH + NH4OH Відповідь: КГідрHCOONa = 4,10·10-10; КГідрHCOONH4 = 2,33·10-5. 12.1. CH3COONa i NH4ClO; 12.5. NH4CN i KCN; 12.2. NH4NO3 i CH3COONH4; 12.6. (NH4)2CO3 i (NH4)2S; 12.3. NH4Br i NH4F; 12.7. K3PO4 i (NH4)2SO3. 12.4. NaF i NH4Cl; 3.Основні закони хімічних перетворень із зміною ступенів окиснення елементів або їх валентності. Що треба знати: Ø Визначення та основні ознаки окисно-відновних реакцій; Ø Поняття "ступінь окиснення елементу"; Ø Що являє собою процес окиснення й основні відновники; Ø Що являє собою процес відновлення й основні окисники; Ø Найважливіші правила складання рівнянь окисно-відновних реакцій методом електронного балансу; Ø Типи окисно-відновних реакцій; Ø Вплив середовища на протікання окисно-відновних реакцій. Що треба вміти: Ø Розраховувати ступені окиснення елементів у сполуках; Ø Визначати окисники та відновники в реакції на основі значень ступенів окиснення елементів, положення елементів у періодичній системі, а також типових хімічних властивостей сполук; Ø Складати до окисно-відновних реакцій схеми перерозподілу електронів; Ø Підбирати та розставляти коефіцієнти в реакціях із зміною ступеня окиснення елементів. Про що треба мати уявлення: Ø Як складати окисно-відновні реакції методом напівреакцій; Ø Як визначається напрямок протікання окисно-відновних реакцій на основі розрахунку електродного потенціалу системи як різниці стандартних електродних потенціалів окисника та відновника. 3.1. Роль окисно-відновних процесів у хімії й біології. Окисно-відновні реакції (ОВР) - найбільш широко розповсюджений тип хімічних реакцій. Велике значення мають ОВР у хімічному виробництві, зокрема, у виробництві кислот - H2SO4, HNO3, H3PO4, мінеральних добрив, тощо; в аналітичній хімії для якісного та кількісного визначення іонів [6-10]. Наприклад, якісна реакція "відкриття" Mn2+ відбувається в кислому середовищі в присутності окисника (NaBiO3, PbO2) з утворенням Mn7+ (НMnО4) і супроводжується утворенням характерного малинового забарвлення розчину. 2Mn(NO3)2 + 5NaBiO3 + 14HNO3 = 2НMnО4 + 5NaNO3 + 5Bi(NO3)3 + 7H2O Bi5+ + 2e ® Bi3+ 5 окисник Якісна реакція відкриття SO32- відбувається в кислому середовищі у присутності окисника КMnО4 (розчин знебарвлюється): 5Na2SO3 + 2КMnО4 + 3H2SO4 = 5Na2SO4 + 2MnSО4 + К2SO4 + 3H2O Mn7+ + 5e ® Mn2+ 2 окисник На окисно-відновних реакціях у кількісному визначені основані редоксметоди об'ємного аналізу: перманганатометрія, йодометрія, хроматометрія та інші, а також використання редоксіндикаторів. В біології до найважливішої окисно-відновної реакції відноситься процес фотосинтезу. Це єдиний унікальний процес у біосфері, в якому відбувається поглинання енергії Сонця і беруть початок усі прояви життя на Землі. Загальне рівняння цього процесу: 6СО2 +6H2O ® С6Н12О6 + 6О2 2О2- - 4е ® О2 4 6 О6 Кисень О2 необхідний для дихання багатьох організмів. Багато іонів перехідних металів мають змінну валентність і здатні до участі в окисно-відновних реакціях: Mn, Co, Mo - активують ряд ферментів. Se - захищає від окисної дії вільних радикалів та іонів важких металів. В біонеорганічних комплексних системах суттєву роль відіграють окисно-відновні пари Fe2+/Fe3+ і Cu+/Cu2+. Харчові продукти в організмі окиснюються киснем і є джерелом енергії для виконання певної роботи й джерелом тепла для підтримування постійної температури тіла. Біосферу можна розглядати як єдину гігантську хімічну лабораторію, в якій постійно відбувається безліч хімічних перетворень, переважна більшість, із яких є окисно-відновними. У кругообігу речовин у боісфері приймають участь водень, кисень, карбон, азот, сірка, фосфор. 3.2. Окисно-відновні реакції на електродах. Стандартні електродні потенціали. Гальванічний елемент. Будь-який процес окиснення-відновлення пов'язаний з переміщенням електронів між іонами реагуючих речовин, що еквівалентно електричному струму (який виникає в спрямованому потоці електронів). При зануренні металічної пластинки (електроду) у розчині солі цього ж металу, то між металом і розчином у стані рівноваги виникає подвійний електронний шар, який приводить до появи стрибка потенціалу, який називається електродним потенціалом (Е Men+/Me). Процес переходу метала в розчин, який пов'язаний із втратою атомами електронів і утворенням позитивно заряджених іонів, є процесом окиснення: Ме - ne ® Men+. В результаті відновлення іонів металу з розчину відбувається приєднання електронів: Men+ + ne ® Ме [6]. Електродний потенціал залежить від природи метала (його активності), концентрації його іонів у розчині, температури. Абсолютна величина електродного потенціалу вимірюванню не підлягає, але легко вимірюється різниця двох стрибків, яка називається електрорушійною силою (ЕРС) гальванічного елементу [1,6]. Якщо в такому пристрої умовно прийняти за нуль потенціал стандартного (або нормального) водневого електрода (складається з платинової пластинки, яка вкрита губчатою платиною і частково занурена у розчин кислоти з активністю іонів АН+ = 1; омивається електрод газоподібним воднем під тиском 1 атм = 1,013·105 Па, що приводить до утворення системи Н2 « 2Н+ + 2е), то вимірюючи ЕРС, можна отримати відносні значення інших електродних потенціалів. Це важливо для порівняльної кількісної характеристики окисно-відновної здібності різних систем. Для вимірювання електродних потенціалів металів, наприклад, міді, складається гальванічний елемент за схемою: відновник, (-) Н2 / 2Н+ Cu2+ / Cu (+) окисник, Напрямок руху іонів у розчині, внутрішній ланцюг. ЕРС = В основі роботи складного елемента лежить реакція: Cu2+ + Н2 ® 2Н+ + Сu окисна відновна окисна відновна форма форма форма форма Електродні потенціали металів, які виміряні відносно електроду в стандартних умовах, тобто концентрації іонів метала в розчині 1 моль/л (А = 1), і температурі 25 оС (298К), називають стандартними. Електрохімічний ряд напруг металів (Додатки) - це ряд металів, розміщених за зростанням алгебраїчного значення стандартних (нормальних, які виміряні в 1н розчинах) потенціалів, або ряд активності металів. Зліва направо в ряду напруг зменшується активність відновної форми (метал) і збільшується активність окисненої форми (іони метала), тому кожний метал окиснюється іонами іншого, який стоїть правіше [7]: Zn + Pb2+ ® Zn2+ + Pb. Величина електродних потенціалів залежить від концентрації іонів метала, в розчині його солі (С), їх заряду (N) і температури (Т), яка знаходить вираження за формулою Нернста.
|
|||||||||||||||||||||||||||||||||||||||||||||||
| Последнее обновление 27.11.11 21:10 |

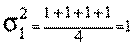
 ;
; 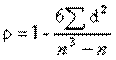 г/мл.
г/мл.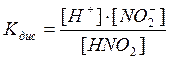 .
.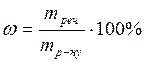 ;
; 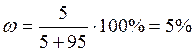 .
. ;
; 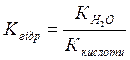 ;
; 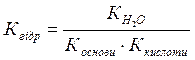 ;
;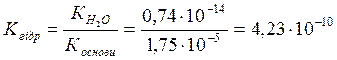
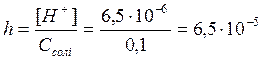 або 6,5·10-3%
або 6,5·10-3%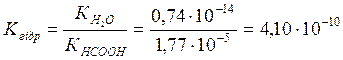 ;
;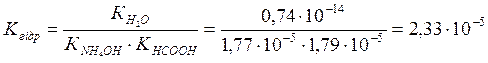 .
.


