| МЕТОДИЧНІ ВКАЗІВКИ З курсу загальної, неорганічної і біонеорганічної хімії Для виконання завдань із самостійної роботи |
 |
 |
| Учебники методички лекции рабочие программы - Методички, методические указания | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27.11.11 19:43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 4 из 5
3.3. Рівняння Нернста.
Принцип розрахунку напрямку окисно-відновних реакцій.
N - заряд іона; F - число Фарадея, 96500 кулонів; R - універсальна газова стала (8,313 Дж); Т - температура, К
У скороченому вигляді рівняння має вигляд:
У гомогенних окисно-відновних системах електродні потенціали називають окисно-відновними або редокс-потенціалами (складається гальванічний елемент внесенням у розчини інертних - платинових електродів). Стандартні значення редокспотенціалів також знаходяться за водневим електродом. В системі як окисник завжди діє окиснена форма (ОФ) із більшим алгебраїчним значенням потенціалу. Можна визначити можливість і напрямок тих чи інших окисно-відновних реакцій. Для гомогенних окисно-відновних систем рівняння Нернста має вигляд:
N- число електронів, який приймає окисник; X, y - стехіометричні коефіцієнти в рівнянні реакцій. Обов'язковою умовою протікання будь-якої окисно-відновної реакції є позитивне значення різниці потенціалів окисника й відновника DЕ = ЕоОФ - ЕоВФ > 0. Чим більша ця різниця, тим більш енергійно проходить реакція [6, 8]. Приклади рішення завдань. Приклад 1. Чи буде взаємодіяти нікель із розведеною сірчаною кислотою? Ni + H2SO4 = NiSO4 + H2 Розв'язок: DЕ = 0 - (-0,250) = 0,250В > 0. Отже, нікель буде взаємодіяти із сульфатною кислотою. Приклад 2. Визначити можливість протікання реакції: Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O Розв'язок: DЕ = Отже, реакція буде протікати. Приклад 3. В якому напрямку можуть протікати реакції, виражені рівняннями: 1) 2Fe3+ + 2І - « 2Fe2+ + І2 2) Cl2 + 2І - « 2Cl - + І2 ? Розв'язок:
Приклад 4. В якому напрямку буде переважно протікати реакція? Pb2+ + NO3- + H2O « PbO2 + H+ + NO2- Розв'язок: DЕ1(прямої р-ції) = окисн. форма відн. форма DЕ1< 0, реакція протікати не буде. DЕ2(зворотньої р-ції) = DЕ2 > 0, тому переважно буде протікати зворотна реакція. Приклад 5. Чи можуть одночасно існувати у розчині речовини Na2SO3 та KMnO4? Розв'язок: DЕ = В розчині одночасно не можуть існувати ці речовини, тому що DЕ > 0 і, відповідно, ці речовини реагують між собою, тобто, протікає реакція.
3.4. Окисно-відновні реакції: (прогнозування, закономірності, складання рівнянь). Контрольні завдання: 1. Визначить ступінь окиснення у сполуках: 1.1. KCl, Cl2, KClO, KClO3, KClO4; 1.2. K2Cr2O7, K2CrO4, Cr2(SO4)3, Cr; 1.3. F2O, O2, H2O, O3, CO2, Na2O2; 1.4. KMnO4, K2MnO4, MnO2, Mn; 1.5. NH3, N2, N2H4, KNO2; 1.6. H2C2O4, HCOOH, CH3COOH, C2H6; 1.7. H3PO3, PH3, Ca(H2PO4)2, (NH4)3PO4. 2. Які окисно-відновні властивості (тільки відновник, тільки окисник, або і ті, і інші) можуть виявляти в зазначених сполуках: 2.1. Манган: KMnO4, K2MnO4, MnO, Mn2O7, MnO2, Mn; 2.2. Хлор: KCl, Cl2, KClO, KClO3, KClO4; 2.3. Сульфур: S, Н2S, Н2SO3, SO3, FеS, SO2; 2.4. Фосфор: H3PO3, PH3, Р2О5, Р, H4P2O7, H3PO4; 2.5. Ферум: Fе(NO3)3, FeSO4, Fe, FeS, Fe2O3; 2.6. Йод: І2, KІ, KІO3, Ca(ІO3)2, HІ; 2.7. Нітроген: NH4NO3, NH2OH, HN3, N2O, NO. 3. Яка з наведених реакцій відноситься до окисно-відновних. Визначити для ОВР коефіцієнти й урівняти всі рівняння реакцій: 3.1. CaCO3 ® CaO + CO2 KClO3 ® KCl + O2 NaOH + Fe2(SO4)3 ® Fe(OH)3 + Na2SO4; 3.2. CH4 + O2 ® CO2 + H2O AgNO3 + HCl ® AgCl + HNO3 NO + O2 ® NO2; 3.3. MnO2 + KOH + KNO3 ® K2MnO4 + KNO2 + H2O CaCl2 + Na3PO4 ® Ca3(PO4)2 + NaCl Н2S + Cu(NO3)2 ® CuS + HNO3; 3.4. KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O Mn2O7 + KOH ® KMnO4 + H2O BaCl2 + K3PO4 ® KCl + Ba3(PO4)2; 3.5. MnO2 + KOH ® K2MnO3 + H2O MnO2 + HCl ® MnCl2 + Cl2 + H2O MnCO3 ® MnO + CO2; 3.6. H2S + HNO3 ® H2SO4 + NO2 +H2O Ca(NO3)2 + K2CO3 ® CaCO3 + KNO3 (NH4)2CO3 + NaOH ® NH3 + Na3CO3 + H2O; 3.7. H2S + H2SO3 ® S + H2O H2S + ZnCO3 ® ZnS + CO2 + H2O NaNO3 ® NaNO2 + O2. 4. До якого типу ОВР (міжмолекулярна, внутрішньомолекулярна, диспропорціювання) відноситься наведена реакція. Визначити коефіцієнти й урівняти рівняння реакцій: 4.1. Pb(NO3)2 ® PbO + NO2 + O2; 4.2. NH4NO2 ® N2 + H2O; 4.3. KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O; 4.4. HNO2 ® HNO3 + NO + H2O; 4.5. H2 + Br2 ® HBr; 4.6. NH4NO3 ® N2O+ H2O; 4.7. K2SO3 ® K2SO4 + K2S. 5. Визначити окисник і відновник у реакції, навести для них електронну формулу й електронну схему та можливі ступені окиснення. Урівняти рівняння реакцій: 5.1. Al + NaOH + H2O ® Na[Al(OH)4] + H2; 5.2. Cu + HNO3(розв) ® Cu(NO3)2 + NO + H2O; 5.3. H2S + SO2 ® S + H2O; 5.4. Pb(NO3)2 ® PbO + NO2 + O2; 5.5. FeS2 + O2 ® SO2 + Fe2O3; 5.6. Mg + HNO3(розв) ® Mg(NO3)2 + NH4NO3 + H2O; 5.7. K2MnO4 + H2O ® KMnO4 + MnO2 + KOH. 6. Підібрати коефіцієнти ОВР. Вказати окисник і відновник. У відповіді дайте загальну суму коефіцієнтів реакції: 6.1. KClO3 + HCl ® KCl + Cl2 +H2O; 6.2. K2Cr2O7 + SO2 + H2SO4 ® Cr2(SO4)3 + K2SO4 + H2O; 6.3. Na2S2O3 + Cl2 +H2O ® H2SO4 + NaCl + HCl; 6.4. SO2 + Cl2 +H2O ® H2SO4 + HCl; 6.5. KІ + H2SO4 ® І2 + KHSO4 + H2S + H2O; 6.6. KMnO4 + H2S + H2SO4 ® K2SO4 + MnSO4 + S +H2O; 6.7. KClO3 + H2C2O4 ® K2CO3 + ClO2 + CO2 + H2O. 7. Скласти рівняння реакцій, за допомогою яких можна здійснити такі перетворення: 7.1.
7.2.
7.3. Na ® Na2O2 ® Na2O® NaNO2; 7.4. CrSO4 ® Cr2(SO4)3 ® NaCrO2 ® Na2CrO4; 7.5. KMnO4 ® KOH ® KCrO2 ® Cr2(SO4)3 ® K2Cr2O7; 7.6. H2S ® S ® SO2 ® SO3 ® Al2(SO4)3; 7.7.
8. Складіть рівняння всіх можливих реакцій між наведеними речовинами, взявши їх попарно: 8.1. Cl2, HBr, NaOH, O2; 8.5. Ba, ZnSO4, H2O, HCl; 8.2. SO2, Al, H2O, HCl; 8.6. Br2, MnO2, O2, H2O; 8.3. H2O2, Br2, KMnO4, HІ; 8.7. P, HNO3(конц), H2, Na. 8.5. K2Cr2O7, NaCl, H2S, O2; 9. Складіть окисно-відновні рівняння реакцій між наведеними сполуками: 9.1. гідрид літію та кисень; 9.2. хлор та йод за наявності води (один із продуктів реакції містить галоген у ступені окиснення +5); 9.3. перманганат калію та йодид калію у водному розчині; 9.4. гідрид барію та хлорнуватиста кислота; 9.5. пероксид водню та хлорид феруму (ІІ) у лужному середовищі; 9.6. тіосульфат натрію та йод, взятий у надлишку; 9.7. оксид хрому(VI) та сульфатна кислота. 10. Чи можуть одночасно існувати у розчині такі речовини? Відповідь обґрунтуйте розрахунками різниці потенціалів: 10.1. KІO3 i KІ; 10.5. HCl i KMnO4; 10.2. HІ i KClO3; 10.6. K2SO3 i MnO2; 10.3. HCl i HClO3; 10.7. H2S i K2MnO4. 10.4. KBr i KMnO4; 11. Довести розрахунками, чи буде взаємодіяти з розчином хлороводневої кислоти вказаний метал: 11.1 Ni; 11.5. Cu; 11.2. Bi; 11.6. Au; 11.3. Sn; 11.7. Pd. 11.4. Pb; 12. В якому напрямку можливе протікання реакції: 12.1. Mn + Ni2+ « Mn2+ + Ni; 12.2. 2MnO41- + 16H+ + 5S2- « 2Mn2+ + 5So + 8H2O; 12.3. Cl2 + 2І1- « 2Cl1- + І2; 12.4. 10Fe2+ + 2MnO41- + 16H+ « 2Mn2+ + 10Fe3+ + 8H2O; 12.5. 3S2- + Cr2O72- + 14H+ « 3So + 2Cr3+ + 7H2O; 12.6. 2MnO41- + 10Cl1- + 16H+ « 2Mn2+ + 5Cl2 + 8H2O; 12.7. KClO3 + 5KCl + 6H+ « 6K+ + 3Cl2 + 3H2O. 3.5. Координаційні комплексні сполуки, їх роль у живій природі. Просторова інтерпретація координаційних чисел, ізомерія координаційних сполук. Що треба знати: Ø Типи хімічних зв'язків у молекулах простих і складних речовин: іонний, ковалентний полярний і ковалентний неполярний; Ø Механізм донорно-акцепторного способу утворення ковалентного зв'язку; Ø Типові донори й акцептори електронних пар і особливості їх електронної будови; Ø Основні закономірності будови координаційних (комплексних) сполук; Ø Найпоширеніші координаційні числа комплексоутворювачів. Що треба вміти: Ø Визначати внутрішню сферу, ступінь окиснення та можливе координаційне число коплексоутворювача, виходячи з особливостей будови елементу; Ø Розраховувати заряд комплексних іонів; Ø Складати рівняння найпростіших реакцій утворення комплексних сполук із використанням у якості лігандів NH3, CN-, NO2-, а комплексоутворювачів - Cu2+, Ag+, Fe2+, Fe3+, Co2+, Co3+ та інші; Ø Складати рівняння дисоціації комплексних сполук у розчинах; Ø Складати назви комплексних сполук. Що треба мати уявлення: Ø Ізомерію комплексних сполук; Ø Константи стійкості комплексних сполук; Ø Особливості деяких типових біологічно активних комплексів як, наприклад, хлорофіл, гемоглобін, ферменти тощо. Теоретичний матеріал міститься в обов'язковій літературі [1,2] і в додатковій [6-10]. Найважливіші з речовин, що входять до складу живих організмів білки, які в свою чергу містять амінокислоти. Амінокислоти з металами здатні утворювати внутрішньокомплексні сполуки, наприклад,
В організмах тварин і рослин координаційні (комплексні) сполуки виконують різноманітні функції: накопичення й переміщення різних речовин та енергії, обмін і блокування функціональних груп, участь в окисно-відновних реакціях, утворення й розщеплення хімічних зв'язків, тощо. До числа найбільш важливих природних хелатуючих агентів відносяться похідні порфіну - один із них гемоглобін. Він виконує дві біохімічні функції: своїми атомами залізо зв'язує молекули кисню і переносить їх у тканини; у тканинах відщеплюється кисень, гемоглобін за допомогою аміногруп зв'язує вуглекислий газ і постачає його в легені. Для рослин важливим зеленим пігментом є хлорофіл, без якого не може існувати фотосинтез. Основу молекули хлорофілу складає магнійпорфіріновий комплекс, який за будовою нагадує гемоглобін. Важливою координаційною сполукою, яка грає важливу роль у синтезі гемоглобіну - є вітамін В12, у склад якого входить кобальт (ІІІ). Багато біометалів утворюють координаційні сполуки з нуклеїновими кислотами і нуклеотидами. Так, у клітині молекули АТФ знаходяться в основному у вигляді комплексів із магнієм. АТФ у свою чергу - джерело енергії для багатьох хімічних реакцій. Деякі вітаміни схильні до комплексоутворення з металами. Успішно використовуються комплексони у рослинництві, медицині, харчовій промисловості та в інших галузях. В більшості комплексних сполук координаційне число комплексоутворювача залежить від числа вільних електронних орбіталей. У свою чергу координаційне число впливає на геометричну форму комплексних частинок.
У просторі шість рівноцінних орбіталей розміщуються в напрямку вершин октаедра. Октаедричне розміщення найбільш вигідне за щільністю упаковки й енергії системи: [Pt(NH3)2Cl4], [Fe(H2O)6]2+ та ін. Комплекси з координаційним числом 4 можуть бути або тетраедричні [Zn(NH3)4]2+, [Zn(CN)4]2-, або площиноквадратні [Cu(NH3)4]2+, [Pt(NH3)2]Cl2. В залежності від просторової координації лігандів розрізняють Цис- або Транс- ізомери (геометрична ізомерія):
Цис - транс- Крім геометричної ізомерії відомі й інші види - іонізаційна, сольватна, сольова, оптична. 3.6. Приклади реакцій утворення найпоширеніших типів координаційних сполук, їх дисоціація, константи нестійкості й стійкості. При взаємодії деяких осадів із надлишком осаджувача, відбувається розчинення осаду. Так, взаємодія HgCl2 і KІ супроводжується утворенням осаду HgІ2 яскраво-червоного кольору, який при додавання надлишку KІ розчиняється [8]: HgCl2 + 2KІ ® HgІ2¯ + 2KCl HgІ2¯ + 2KI ® K2[HgІ4]. При осадженні Zn2+ дією NH4OH, спочатку утворюється осад Zn(ОН)2, який розчиняється в надлишку амоніаку з утворенням комплексної сполуки [Zn(NH3)6](OH)2: Zn(ОН)2 + 6NH4OH ® [Zn(NH3)6](OH)2 + 6H2O. Аналогічно протікає реакція осадження AgCl, а потім його розчинення внаслідок утворення комплексної сполуки H[AgCl2] або Na[AgCl2]: AgCl¯ + HCl ® H[AgCl2] або AgCl¯ + NaCl ® Na[AgCl2]. Молекули комплексних сполук утворюються в результаті взаємодії електрично-нейтральних молекул більш простих за складом солей: Fe(CN)2 + 4KCN ® K4[Fe(CN)6] Fe(CN)3 + 3KCN ® K3[Fe(CN)6] AgCl + 2NH4OH ® [Ag(NH3)2]Cl + 2H2O. Координаційна теорія Вернера пояснює утворення координаційних сполук [9]. Обов'язковою умовою одержання таких сполук є наявність координаційного зв'язку (реалізація донорно-акцепторного механізму ковалентного зв'язку). Прикладом утворення координаційних сполук різних типів (катіонних, аніонних, нейтральних) можуть бути реакції: 1) утворення катіонного типу координаційних сполук CoSO4 + 6NH4OH(надл) ® [Co(NH3)6]SO4 + 6H2O PtCl4 + 6NH4OH(надл) ® [Pt(NH3)6]Cl4 + 6H2O 2) утворення аніонного типу AlCl3 + 6NaOH(надл) ® Na3[Al(OH)6] + 3NaCl Більшість координаційних сполук у розчинах виявляють властивості сильних електролітів і дисоціюють на комплексні іони й іони зовнішньої сфери [5]: [Cu(NH3)4]SO4 « Cu2+ + SO42-. Дисоціація комплексних іонів відбувається в незначній мірі подібно слабким електролітам (ступінчасто) і характеризується кожний ступінь дисоціації константою рівноваги - ступінчастою константою стійкості. Константа стійкості - обернена величина константи нестійкості, або константи дисоціації комплексного іона: [Сu(NH3)4]2+ « [Сu(NH3)3]2+ + NH3 [Сu(NH3)3]2+ « [Сu(NH3)2]2+ + NH3 [Сu(NH3)2]2+ « [Сu(NH3)]2+ + NH3 [Сu(NH3)]2+ « Сu2+ + NH3 В загальному вигляді: [Сu(NH3)4]2+ « Сu2+ + 4NH3 За величинами константи стійкості (нестійкості) можна кількісно порівнювати різні комплексні сполуки, передбачати перебіг хімічних реакцій. Чим більше значення стійкості, тим стійкіші комплекси. Контрольні завдання: 1. Заповніть таблицю у відповідності з Вашим варіантом, вказавши комплексоутворювач, ліганди, координаційне число, внутрішню та зовнішню сферу по формулі комплексної сполуки, або скласти відповідну формулу по вказаному комплексоутворювачу, лігандам та координаційному числу. Дайте назви відповідним сполукам.
2. Визначити ступінь окиснення і координаційне число комплексоутворювача в наступних комплексних сполуках: Приклад: K2[HgI4]; комплексоутворювач – Hg2+; координаційне число – 4. 2.1. Na3[AlF6], [Ga(NH)3]Br3, [Ni(H2O)6]SO4, K2[SnCl4]. 2.2. H[Au(NO3)4], K4[Fe(CN)6], Ba[Pt(CN)4], [Co(H2O)6]Br2. 2.3. [Zn(NH3)4]Cl2, K2[Cu(CN)4], Fe3[Fe(CN)6]2, [Pt(NH3)2Cl2]. 2.4. Na2[Be(HO)4], (NH4)2[Co(SCN)4], K[Au(CN)2], Na3[Ag(S2O3)2]. 2.5. K3[Fe(CN)6], Na3[Al(OH)6], [Pt(NH3)6](NO3)2, Na2[SiF6]. 2.6. Zn[Hg(SCN)4], Na3[FeF6], [Co(NH3)5Cl]SO4, [Ni(NH3)6]Cl2. 2.7. K3[Cr(SCN)6], [Co(NH3)5SO4]Cl, NH4[Fe(SO4)2], [Pt(NH3)2Cl4]. 3. Написати наведені нижче формули у вигляді комплексних сполук і дати їм назви: Приклад: 2 KI·HgI2 ® K2[HgI4] – тетрайодомеркурат калію. 3.1. 2HF·SiF4; 3.5. KF·BF3; 3.2. 2KCl·PbCl2; 3.6. 2NH4SCN·Co(SCN)2; 3.3. FeCl3·6H2O; 3.7. Zn(OH)2·Ca(OH)2. 3.4. Cr2(SO4)3·12NH3; 4. На які йони дисоціюють наступні комплексні й подвійні солі? Скласти рівняння їх дисоціації: Приклад: [Cu(NH3)4]Cl2 « [Cu(NH3)4]2+ + 2Cl-. 4.1. Na3[FeF6]; 4.5. Na2[Zn(OH)4]; 4.2. Na2[Pb(OH)4]; 4.6. [Ni(NH3)6]Cl3; 4.3. (NH4)2SO4·FeSO4; 4.7. К3[Co(CN)6]. 4.4. K2SO4·Cr2(SO4)3; 5. Cкласти рівняння реакцій взаємодії амфотерних гідроксидів із лугом. Продукти реакцій записати у вигляді гідроксокомплексів. Вказати координаційне число комплексоутворювачів і написати рівняння дисоціації одержаних комплексних сполук: Приклад: Be(OH)2. 5.1. Al(OH)3; 5.5 Sn(OH)2; 5.2. Zn(OH)2; 5.6. Mn(OH)4; 5.3. Cr(OH)3; 5.7. Sb(OH)3. 5.4. Pb(OH)2; 6. Написати молекулярні та йонні рівняння реакцій між такими речовинами: Приклад: CuCl2 i NH4OH. 6.1. ZnSO4 i K3[Fe(CN)6]; 6.5. FeNH4(SO4)2 i KSCN; 6.2. FeCl3 i K4[Fe(CN)6]; 6.6. NaCl i K[Sb(OH)6]; 6.3. KCl i Na3[Co(NO2)6]; 6.7. CuSO4 i NH3. 6.4. K2[HgІ4] i AgNO3; 7. Написати молекулярні та йонні рівняння реакцій, які реалізуються з утворенням координаційних сполук. Написати рівняння дисоціації відповідних комплексних йонів. Скласти для них вираз констант нестійкості. Приклад: Вираз констант нестійкості див. ст.52. 7.1. AgCl + NH4OH(надл.) ® 7.5. AgCN + KCN(надл.) ® CuSO4 + KCN(надл.) ® Zn(OH)2 + NaOH(надл.) ® 7.2. Zn(OH)2 + NaOH(надл.) ® 7.6. Fe(CN)2 + KCN(надл.) ® Pb(NO3)2 + KІ(надл.) ® Cu3(PO4)2 + NH4OH(надл.) ® 7.3. Al(OH)3 + KOH(надл.) ® 7.7. CdІ2 + KІ(надл.) ® Co(NO2)3 + NaNO2(надл.) ® CoCl3 + NH4OH(надл.) ® 7.4. ZnSO4 + NH4OH(надл.) ® Cr(OH)3 + NaOH(надл.) ®
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Последнее обновление 27.11.11 21:10 |

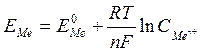 ,
,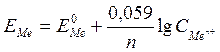
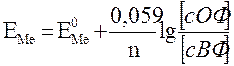 .
.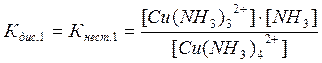 ;
;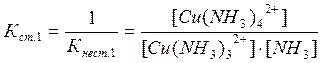 ;
;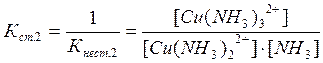 ;
;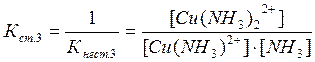 ;
;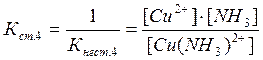 ;
;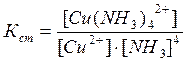 .
.


